基因片段敲除
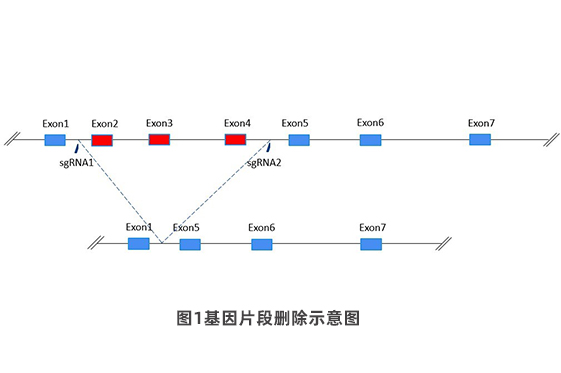
CRISPR-Cas9系统介导的基因敲除目前已广泛应用于基因组功能水平研究,常见的基因敲除策略有两种,一种是单个sgRNA介导的基因敲除,通过CRISPR-Cas9系统在编码基因外显子产生的InDels造成基因移码突变,进而达到基因敲除的目的,因此,此种基因敲除策略仅限于编码基因的敲除;另一种是两条sgRNA介导的基因敲除,通过两条sgRNA作用于目的片段两侧,实现目的片段序列删除,进而实现目的基因的敲除,此种基因敲除策略不仅适用于编码基因,同样适用于非编码功能元件和ncRNA基因,这些非编码DNA序列无法通过移码突变方式达到功能失活的目的,必须依赖于功能片段的缺失(图1)。因此,通过片段删除的方式实现基因的敲除,也是一种应用广泛的基因敲除策略。项目经验查看 下单请点击
服务标准
| 客户需提供 | 安升达交付 | 交付周期 | |
| 标准服务 | 基因序列和NCBI ID 宿主细胞 细胞株培养条件 |
基因敲除(片段删除)单克细胞一株 细胞cofA文件 测序结果 |
10-12周 |
| 附加服务 | – | 额外单克隆交付 | – |
| Western blot/FACS抗体 | 敲除细胞株蛋白水平验证结果 | 1-2周 | |
| – | 敲除细胞株mRNA水平验证 | 1-2周 |
*注:一般由客户提供宿主细胞系,如果需要由安升达提供宿主细胞系,需要额外收费。
*如果宿主细胞使用的是常规培养基,如:RPM1640、DMEM、MEM等无需客户提供,如果是特殊培养基及添加物,需要客户提供。
*如果宿主细胞使用的是常规培养基,如:RPM1640、DMEM、MEM等无需客户提供,如果是特殊培养基及添加物,需要客户提供。
基因片段删除细胞系构建流程:
案例分析1:编码基因片段删除-The stability and oncogenic function of LIN28A are regulated by USP28.
编码基因的敲除有两种常见策略,一种为Crispr/Cas9作用于外显子产生InDels导致移码突变,另一种方法是对编码基因外显子片段删除。本案例中USP28基因为编码基因,一种去泛素化酶,通过与LIN28A蛋白相互作用并稳定其半衰期。USP28通过其去泛素化活性,逆转蛋白酶体降解作用,可拮抗LIN28A蛋白降解。通过在外显子2中设计两条sgRNA进行外显子2片段删除,实现对USP28基因功能的敲除,并验证了敲除后NCCIT细胞中LIN28A蛋白量降低[1]。

图2USP28基因片段删除[1]
案例分析2:非编码基因(LncRNA)片段删除-Efficient CRISPR/Cas9-Mediated Versatile, Predictable, and Donor-Free Gene Knockout in Human Pluripotent Stem Cells
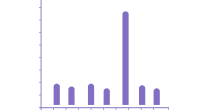
长链非编码RNA(Long non-coding RNA, lncRNA)是长度大于 200 个核苷酸的非编码 RNA。研究表明, lncRNA 在剂量补偿效应、表观遗传调控、细胞周期调控和细胞分化调控等众多生命活动中发挥重要作用,成为遗传学研究热点。本案例中MALAT1基因即为lncRNA基因,仅包含一个外显子,案例从方法学角度在iPSC细胞中对lncRNA基因进行敲除,通过不同sgRNA组合对MALAT1基因外显子片段进行删除,删除序列大小分别为500bp,1000bp,3000bp, 8000bp. 删除效率见下图表格,纯合删除效率随着删除片段越大整体上呈下降趋势[2]。因此,对较大的lncRNA,删除外显子的大小要根据基因的序列特征选择合适的删除片段,才能较大概率获取纯合基因删除单克隆细胞系。
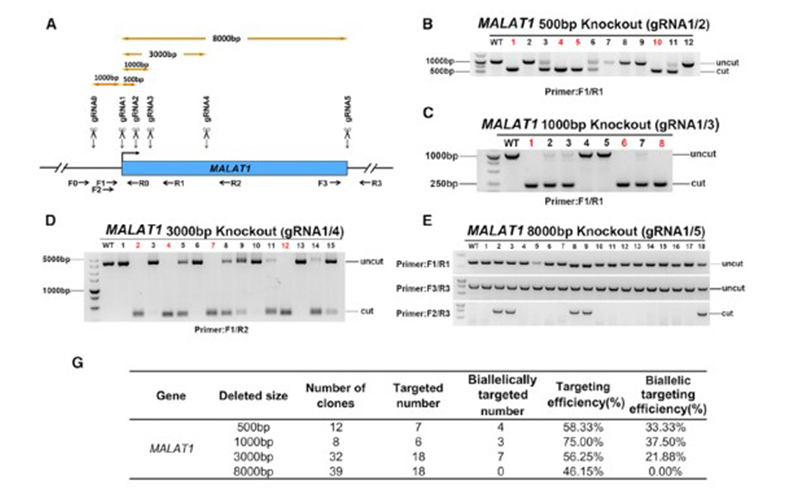
图3 MALAT1基因片段删除[2]
案例分析3:长片段基因删除(>10kb)-Efficient in vivo deletion of a large imprinted lncRNA by CRISPR/Cas9.
基因长片段的删除通常应用于lncRNA基因删除, 且大多应用活体水平的操作。本案例介绍在活体水平删除Rian基因,此基因大小为57.8kb,包含21个外显子,案例中设计删除了包含23kb范围内的14个外显子, 实验结果统计表明,25个小鼠中含有4个显示Rian基因删除[3],但是均为杂合敲除。对于片段删除,总的趋势是随着片段越大,删除效率越低,大片段删除效率范围为总体约1%至13%[4] [5], 可能的原因可能受基因染色体背景影响、DNA修复机制影响。此外,获取纯合删除拷贝困难因素还受基因拷贝数多少等影响。
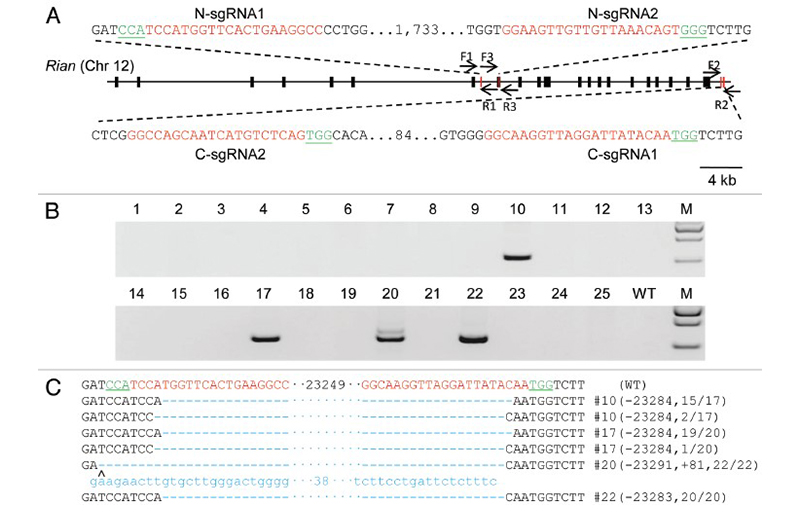
图4 Rian基因片段删除[3]
总而言之,相比通过CRISPR/Cas9产生InDels而介导基因敲除,通过两条sgRNA介导DNA片段删除具有更广泛更可靠的特点,具体表现在(1)可以对非编码基因进行敲除;(2)可以在基因组水平上对DNA片段进行删除;这些都决定了CRISPR/Cas9系统介导的片段删除具有更广泛、更可靠的特点,必将作为基因功能研究的优先选择之一。
参考文献:
[1] Haq S, Das S, Kim D H, et al. The stability and oncogenic function of LIN28A are regulated by USP28[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2019, 1865(3): 599-610.
[2] Liu Z, Hui Y, Shi L, et al. Efficient CRISPR/Cas9-mediated versatile, predictable, and donor-free gene knockout in human pluripotent stem cells[J]. Stem cell reports, 2016, 7(3): 496-507.
[3] Han J, Zhang J, Chen L, et al. Efficient in vivo deletion of a large imprinted lncRNA by CRISPR/Cas9[J]. RNA biology, 2014, 11(7): 829-835..
[4] He Z, Proudfoot C, Mileham A J, et al. Highly efficient targeted chromosome deletions using CRISPR/Cas9[J]. Biotechnology and bioengineering, 2015, 112(5): 1060-1064.
[5] Kraft K, Geuer S, Will A J, et al. Deletions, inversions, duplications: engineering of structural variants using CRISPR/Cas in mice[J]. Cell reports, 2015, 10(5): 833-839.
安升达提供的CRISPR/Cas9技术服务的授权来自Broad研究所。