基因敲入
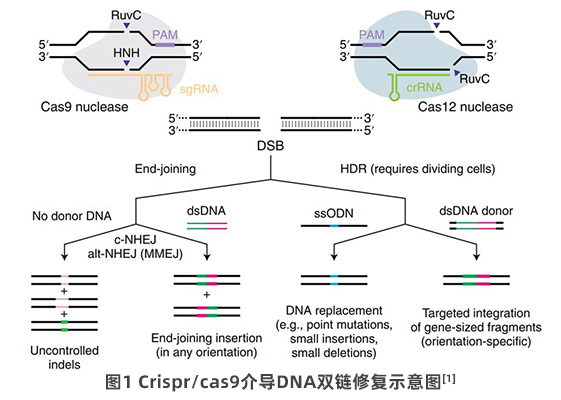
基因敲入(gene knock in)是一种将外源功能基因,整合或替换到基因组特定位点,并在细胞内获得稳定表达的技术。它在基因功能、疾病模型、药物筛选等研究领域有着广泛的应用。然而,基于基因敲入依赖于同源重组(Homologous Recombination)的特点,一定程度上决定了其低概率性,即效率低下始终是基因编辑领域的一大瓶颈,即便结合第三代基因编辑系统CRISPR/CAS9这一强大技术,精确定点敲入的仍然常常难以高效的实现。CRISPR/CAS9介导基因敲入的原理是通过断裂DNA双链,导致细胞内激活DNA修复机制,主要是非同源重组型末端连接(nonhomologous end joining,NHEJ)和同源重组型修复(homology-directed repair,HDR),其中非同源末端连接引发的随机突变,目前已经发展成为基因敲除的主要方法,同源重组修复虽然在自然情况下发生概率很低,但是在外源DNA模板存在的条件下,能够提高同源重组效率(图1),进而介导外源基因的精确敲入。基因敲入效率不仅取决于同源重组的低概率性,还取决于敲入位点、敲入片段大小、细胞系的选择、是否含有筛选标记等众多潜在条件的限制。下面介绍3中常见的基因敲入类型:Tag标签敲入(无痕敲入)、报告基因敲入、基于puro标记筛选的safe harbor位点基因敲入(标记筛选)。
项目经验查看 下单请点击
服务标准
| 客户需提供 | 安升达交付 | 交付周期 | |
| 标准服务 | 基因序列和NCBI ID 宿主细胞 细胞株培养条件 |
基因敲入单克细胞一株 细胞cofA文件 测序结果 |
12-16周 |
| 附加服务 | – | 额外单克隆交付 | – |
| Western blot/FACS抗体 | 敲入细胞株蛋白水平验证结果 | 1-2周 | |
| – | 敲入细胞株mRNA水平验证 | 1-2周 |
*注:一般由客户提供宿主细胞系,如果需要由安升达提供宿主细胞系,需要额外收费。
*如果宿主细胞使用的是常规培养基,如:RPM1640、DMEM、MEM等无需客户提供,如果是特殊培养基及添加物,需要客户提供。
*如果宿主细胞使用的是常规培养基,如:RPM1640、DMEM、MEM等无需客户提供,如果是特殊培养基及添加物,需要客户提供。
基因敲入细胞系构建流程:
案例分析1:Tag标签敲入-An efficient and scalable pipeline for epitope tagging in mammalian stem cells using Cas9 ribonucleoprotein.
V5 标签是从猿猴病毒5(simian virus 5,SV5)P和V蛋白中分离得到的由14个氨基酸残基(GKPIPNPLLGLDST)组成的序列,常被用于跨膜型蛋白和分泌型蛋白的N 末端或者 C 末端进行融合表达,以便对靶蛋白进行分析和鉴定。本案例中在两种来源小鼠神经干细胞目的基因C末端进行V5标签敲入[2],设计左右同源臂79bp左右,在无筛选标记的情况下,分别实现13.9%和17.6%的高效率基因敲入。
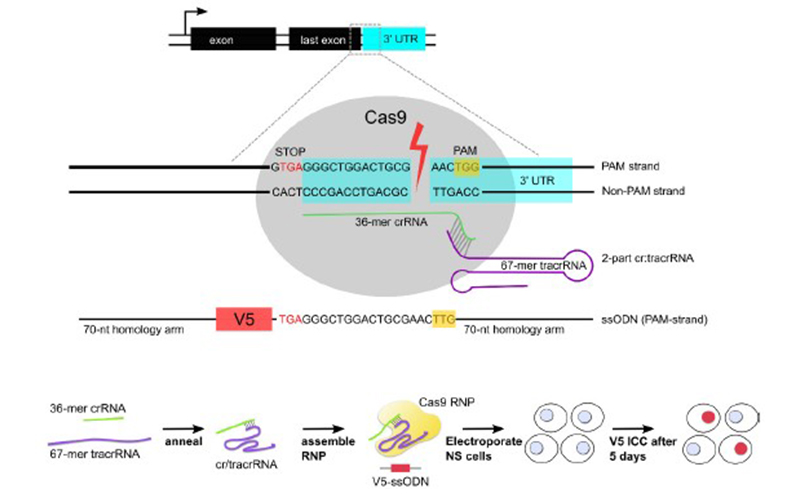
图2 Crispr/cas9介导V5标签敲入[2]
案例分析2:报告基因敲入(无痕敲入)-CRISPR/Cas9-Mediated Gene Tagging: A Step-by-Step Protocol.
报告基因(reportgene)是指一类编码易被检测的蛋白质或酶的基因,常见的报告基因包括荧光类报告基因(GFP和RFP)和荧光素酶类报告基因。报告基因的编码序列和基因表达调节序列融合,或与其他目的基因融合,在调控序列的控制下进行表达,通过检测报告基因的表达产物来标记目的基因的表达调控以及跟踪目的基因。本案例是一篇典型的报告基因敲入方法[3],通过在目的基因C短终止密码子附近设计sgRNA,并依据Cas9切割位点设计左右同源臂,经过药物筛选后(此药物标记存在于打靶载体,仅用于转染标记),阳性pool扩大培养,并通过荧光显微镜观察copGFP表达,挑选荧光阳性细胞进行单克隆培养以及后续验证,成功获取copGFP基因敲入细胞系。
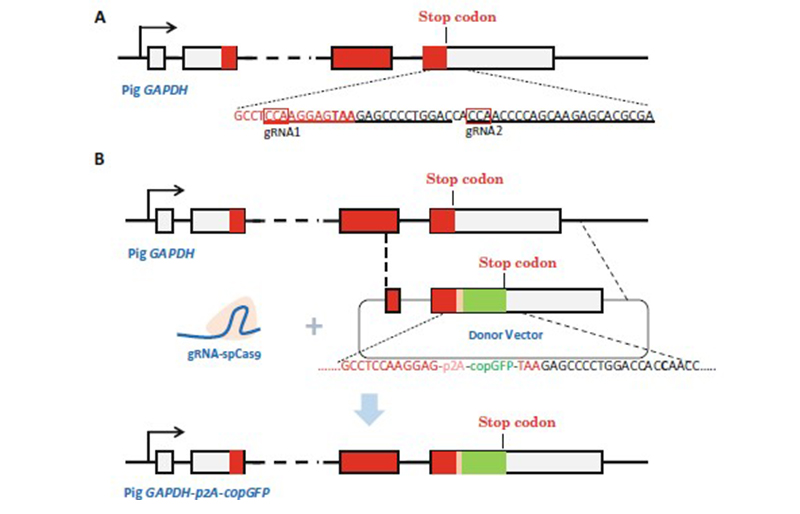
图3 报告基因敲入示意图[3]
案例分析3:基于puro标记筛选的safe harbor位点基因敲入-A high-throughput small molecule screen identifies farrerol as a potentiator of CRISPR/Cas9-mediated genome editing.
Safe harbor 位点是一种经过公认的对细胞或活体影响较小且敲入目的基因后能稳定表达的位点,目前常用的安全位点为AAVS1(人源)和Rosa26(鼠源),但由于基因敲入安全位点是一个低概率事件,为便于阳性细胞克隆筛选,常规的做法是在敲入表达框内加入药物筛选标记,通过2A肽或其他linker连接进行非融合或融合表达,常见的药物筛选标记有Puro, Neo,BSD等。本案例中,通过CRISPR/Cas9系统介导非融合Puro和GFP敲入[4],Puro作用是去除大量无抗性的阴性细胞,通过puro筛选,可以确定外源基因敲入,并结合GFP荧光,可以确定puro和GFP功能序列正确敲入。理论上GFP本身就是一个筛选标记,但是由于敲入的低概率性,单纯的荧光筛选操作困难,引入puro筛选可以去除大量阴性细胞,简化后续单克隆筛选流程。
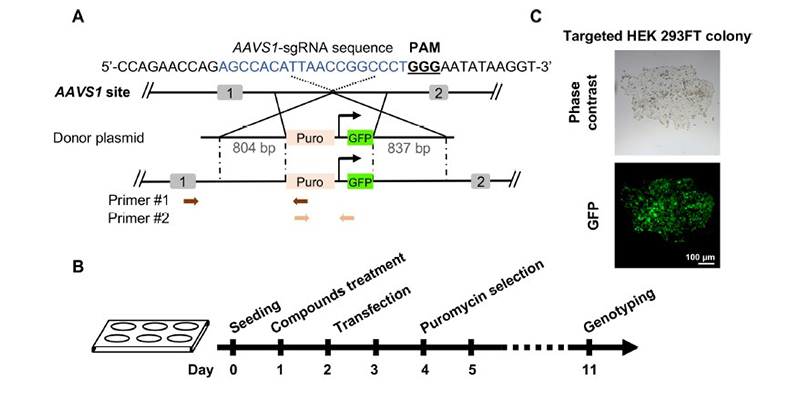
图4 基于puro标记筛选的safe harbor位点基因敲入[4]
总而言之,基因敲入相对来说是一个低概率事件,但随着CRISPR/CAS9系统的出现,使基因敲入效率有了明显的提高,并基于CRISPR/CAS9系统发展了包括同源重组(HR)、单链退火(SSA)、非同源末端连接(NHEJ)、微同源性介导的末端连接(MMEJ)或同源性介导的末端连接(HMEJ)等技术,综合这些实验方案,我们解决基因敲入难题有了更多选择,如何根据自身实验课题选择最理想的方案,往往对实验成败起着决定性作用。安升达凭借强大的技术团队,针对您的需求,综合评估并选取最理想的技术策略,确保及时、高效的为您解决科研上的后顾之忧。
参考文献
[1] Anzalone A V, Randolph P B, Davis J R, et al. Search-and-replace genome editing without double-strand breaks or donor DNA[J]. Nature, 2019, 576(7785): 149-157.
[2] Dewari P S, Southgate B, Mccarten K, et al. An efficient and scalable pipeline for epitope tagging in mammalian stem cells using Cas9 ribonucleoprotein[J]. Elife, 2018, 7:e35069.
[3] Xiang X, Li C, Chen X, et al. CRISPR/Cas9-mediated gene tagging: a step-by-step protocol[M]//CRISPR Gene Editing. Humana Press, New York, NY, 2019: 255-269.
[4] Zhang W, Chen Y, Yang J, et al. A high-throughput small molecule screen identifies farrerol as a potentiator of CRISPR/Cas9-mediated genome editing[J]. Elife, 2020, 9:e56008.
安升达提供的CRISPR/Cas9技术服务的授权来自Broad研究所。