浅谈特殊核苷酸的作用
前两期我们分享了寡核苷酸的荧光基团、淬灭基团修饰,以及间臂类修饰。本期推送将和大家分享寡核苷酸中特殊核苷酸的作用。在常见的A、T、G、C、U基础上,仅仅做了一点改变,或是某个原子的取代,或是某个基团的添加和缺失,但是却给寡核苷酸性质带来比较大的变化,赋予寡核苷酸新的功能。
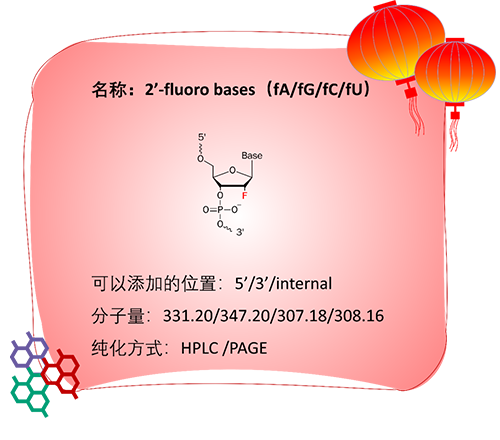
应用:
2′-F是将核糖核苷酸的2′-羟基替换为氟原子。
1)ASO:ASO即anti-sense oligo nucleotide,是一种长度约在12~30nt的单链寡核苷酸片段,ASO的骨架和碱基上通常含有修饰以增强其功能。ASO主要是通过碱基互补配对与靶标mRNA结合,导致RNase H剪切靶标mRNA,从而抑制基因表达;也有ASO通过抑制ribosome翻译蛋白、调节RNA splicing等机制发挥作用。
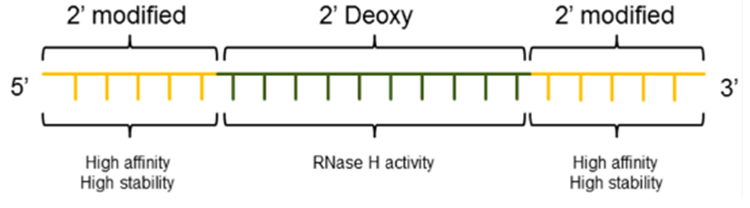
向ASO中每掺入一个2′-F修饰的核苷酸,ASO与其靶标RNA结合的Tm值可升高约1.8℃,因此向ASO中引入2′-F可提高ASO与靶标的结合力,同时提高了ASO的核酸酶抗性。值得注意的是,我们提到ASO作用机制依赖于RNase H,而RNase H发挥作用需要RNA的2’-羟基,因此2’-羟基处的修饰可能影响ASO的功能,为解决这个矛盾,可采用Gapmer的设计方式:ASO两端的序列采用2’位修饰以提高核酸酶抗性和结合力,而中间未修饰部分可招募RNase H [1]。
图片来源:《Therapeutic Oligo nucleotides Targeting Liver Disease: TTR Amyloidosis》
2)aptamer(核酸适配体):适当添加2′-F修饰的核苷酸可提高aptamer的血清稳定性,并可能提高aptamer与靶标的结合能力。例如Macugen(pegaptanib)是一个靶向VEGF的aptamer,被批准用于治疗眼部血管疾病,比如老年黄斑变性。该药物在血清中的半衰期长达18小时(未经修饰的aptamer在血清中的半衰期通常只有5分钟),并且研究发现2′-F修饰提高了aptamer与靶标配体的结合力[2]。
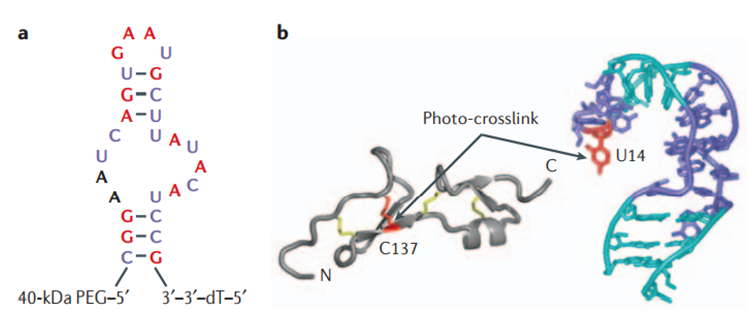
图片来源:《Pegaptanib, a targeted anti-VEGF aptamer for ocular vascular disease》
(图a pegaptanib为红色碱基为2’-OMe修饰,蓝色碱基为2’-F修饰;图b为pegaptanib与VEGF结合)
3)siRNA:研究已经表明siRNA的sense-strand上引入2′-F修饰不影响RISC复合物的激活,因此2′-F可修饰在siRNA中,提高siRNA在血清中的稳定性[3]。
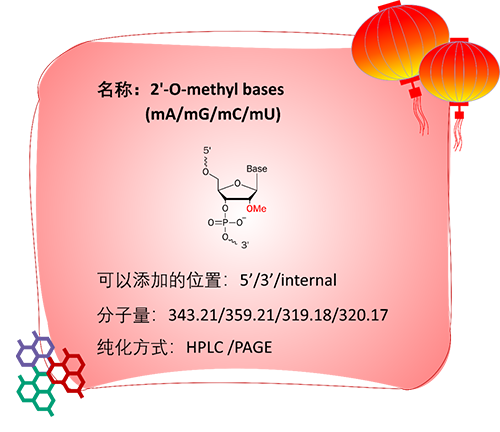
应用:
2′-OMe是将核糖核苷酸的2′-羟基替换为甲氧基。
1)2′-OMe修饰可以提高RNA的核酸酶抗性,经常被应用于ASO、aptamer、siRNA和sgRNA中。例如在sgRNA的5’端和3’端添加2′-OMe修饰与硫代修饰可以增加sgRNA的稳定性,从而提高其编辑效率[4]。
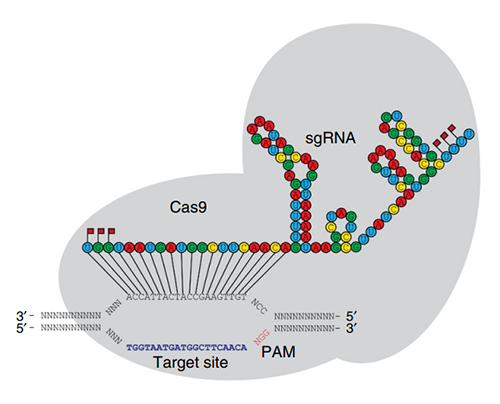
图片来源:《Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells》
(红旗处为修饰的碱基)
与DNA/RNA碱基互补配对相比,2′-OMe RNA/RNA的碱基互补配对更接近于RNA/RNA;因此在ASO中添加2′-OMe修饰可提高ASO对靶标RNA的结合力。
2)有研究发现,miRNA可以被与之互补的2′-OMe修饰的antisense oligo抑制[5]。
3)也有研究表明,将2′-OMe修饰选择性的添加到siRNA中,在不降低其基因沉默能力的同时,可以减少动物体内因注射siRNA导致的细胞因子的产生,即可以降低siRNA的免疫原性[6]。
应用:
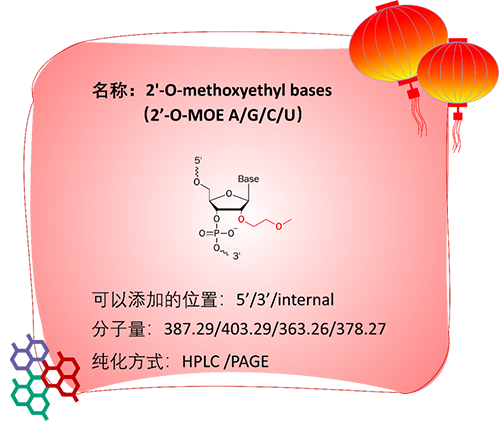
2′-O-MOE与2′-OMe名字相近但实质不同,2′-O-MOE指的是在核糖核苷酸的2′-羟基上的氢替换为甲氧基乙基,这种修饰增加了寡核苷酸对于核酸酶的抗性。
2′-O-MOE修饰在ASO和aptamer中应用广泛。
例如Inotersen是一种序列5’和3’端修饰2′-O-MOE的ASO药物,其靶标是肝细胞transthyretin(转甲状腺素) mRNA的3’非翻译区,用于治疗遗传性转甲状腺素淀粉样病变(一种罕见的常染色体显性遗传病)。研究表明,2′-O-MOE修饰延长了药物的半衰期,提高了ASO药物与靶标mRNA的结合能力[7]。

图片来源:《Oligonucleotides to the (Gene) Rescue: FDA Approvals 2017–2019》
2′-O-MOE修饰在siRNA 5’端或3’端时可能会影响其RNA干扰效应,但是修饰在siRNA的中间位置则影响较小。
应用:
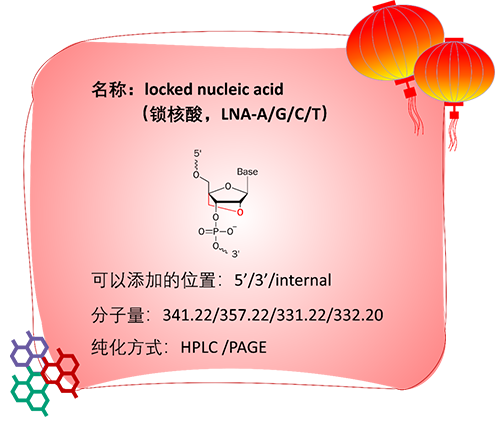
LNA称为锁核酸,是一个主体呋喃糖被“锁定”的双环结构。具体是通过2′-O和4’位之间添加亚甲基连接,赋予原本柔性的呋喃核糖刚性;并且LNA扭曲成了经典的A型构象,更利于碱基堆积力,因此LNA对DNA或RNA表现出极好的结合能力。
根据LNA添加的位置差异与寡核苷酸序列的不同,每掺入一个LNA,寡核苷酸的Tm值可提高3~9℃。LNA与DNA或RNA之间仍然遵循碱基互补配对原则。LNA的添加并非越多越好,比如过多的LNA可能造成寡核苷酸分子内部的杂交。
1)推荐将LNA应用于需要高特异性的杂交检测中:双标探针,原位杂交探针等。
例如在TaqMan PCR中,对于富含AT的序列设计探针可能出现Tm值不够的现象,使用LNA可以在不延长探针的前提下,提高探针Tm值,避免探针过长导致的高背景值。
有研究表明,利用qPCR做SNP(单核苷酸多态性)检测时,与普通引物相比,使用LNA修饰的引物在野生型序列和突变序列之间可得到更高的分离度(ΔCt)[8]。
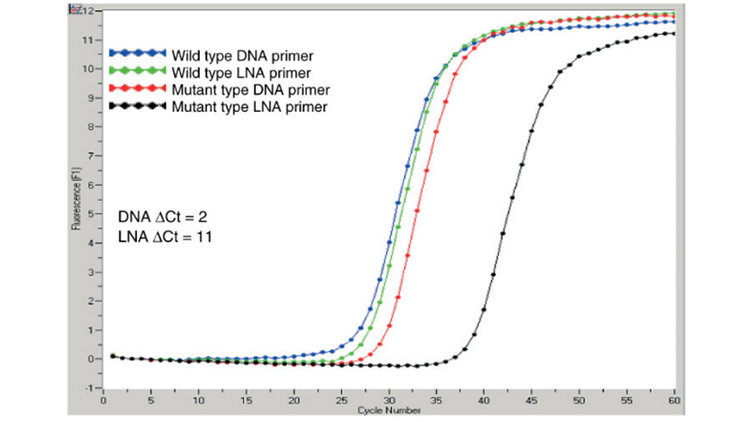
图片来源:《Enhanced Allele-Specific PCR Discrimination in SNP Genotyping Using 30 Locked Nucleic Acid (LNA) Primers》
2)行使RNA抑制功能的寡核苷酸:ASO,siRNA。
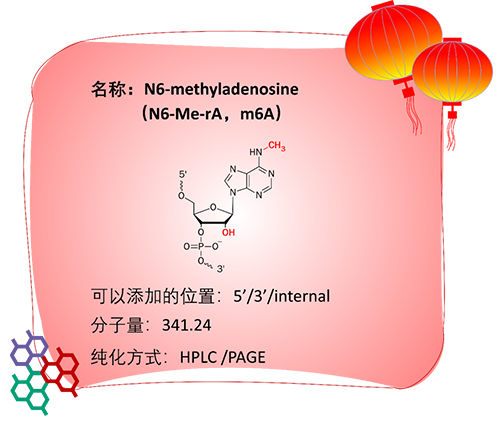
应用:
N6-Me-rA就是我们经常听到的m6A,具体指的是腺嘌呤核糖核苷酸的腺嘌呤碱基第6位的N发生甲基化,是近几年热门的研究方向。m6A是一类在真核生物RNA中广泛存在的修饰,目前已经在mRNA、tRNA、rRNA和long non-coding RNA等非编码RNA中都观察到,这种修饰可影响RNA的剪接、翻译和稳定性等,从而在细胞分化、肿瘤发生和免疫反应等很多生物学过程中发挥重要的调控作用。
有研究表明,在环状RNA中引入m6A修饰可降低其免疫原性。
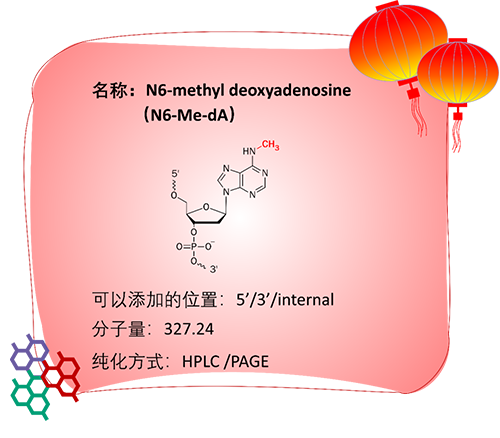
应用:
N6-Me-dA具体指的是腺嘌呤脱氧核糖核苷酸的腺嘌呤碱基第6位的N发生甲基化。相比于m6A,N6-Me-dA是一种存在于DNA上的修饰,最初只在原核生物,特别是细菌中被检测到;近来研究表明,真核生物基因组中也存在N6-Me-dA的修饰。
在细菌中,N6-Me-dA调控细胞周期、DNA的错配修复、基因转录、抗生素耐药性和细菌与宿主间相互作用等[9]。
在高等真核生物中,N6-Me-dA的水平从胚胎发育时期最丰富到成体组织中显著降低,提示N6-Me-dA与发育、再生密切关联。近来也有研究表明,小鼠脑中N6-Me-dA的水平与小鼠所处环境压力相关。
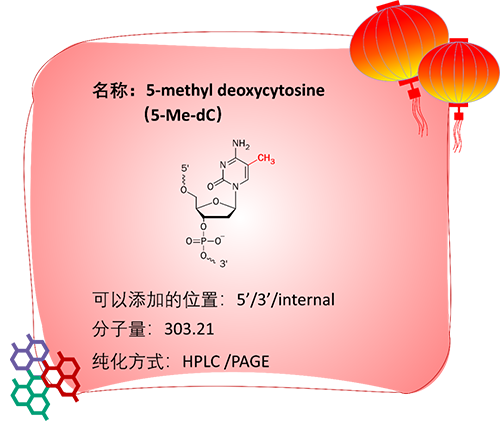
应用:
5-Me-dC指的是5-甲基脱氧核糖胞苷,即在胞嘧啶脱氧核糖核苷酸碱基的第五位修饰甲基。5-Me-dC与dG碱基互补配对,该修饰提高了双链的稳定性,向寡核苷酸中每掺入一个5-Me-dC,寡核苷酸的Tm值可提高约1.3℃。
1)添加到较短的PCR引物中。在一些特殊情况下,PCR模板上引物结合位点有限,或者PCR模板的二级结构可能阻止引物的结合、扩增时,使用5-Me-dC修饰的PCR引物或许可以得到比较好的扩增效果[10]。
2)包含CpG基序的ASO给药到动物体内后,会激活Toll-like receptor 9(Toll样受体9)而引起比较大的免疫反应,研究发现用5-Me-dC替代dC则可以大幅减弱这种免疫反应[11]。
3)在真核生物中,5-Me-dC是最常见的DNA甲基化修饰;哺乳动物中,大多数5-Me-dC发生在CpG位点,并由DNA甲基转移酶将甲基转移到胞嘧啶上进行修饰;5-Me-dC在胚胎发育、肿瘤发生等过程中发挥重要作用。
4)在cfDNA甲基化测序中,5-Me-dC可作为建库中使用的接头引物的修饰,用于分析DNA甲基化的情况。
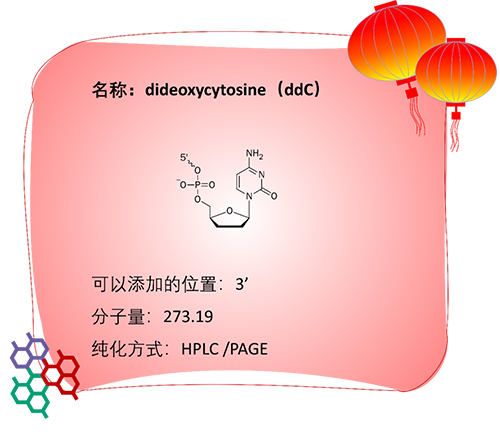
应用:
1)ddC是一种双脱氧核糖核苷酸,属于脱氧胞苷(dC)的类似物。两者的区别在于dC核糖的2’位的羟基被H取代,而ddC核糖的2′和3′位的羟基均被H取代。因此ddC主要连接在寡核苷酸的3’端,用于阻止寡核苷酸向后延伸。
2)在miRNA测序建库中,使用5′-rApp修饰的寡核苷酸adapter,这类adapter的3’端修饰ddC,用以阻止adapter之间的互相连接或分子内的环化[12]。
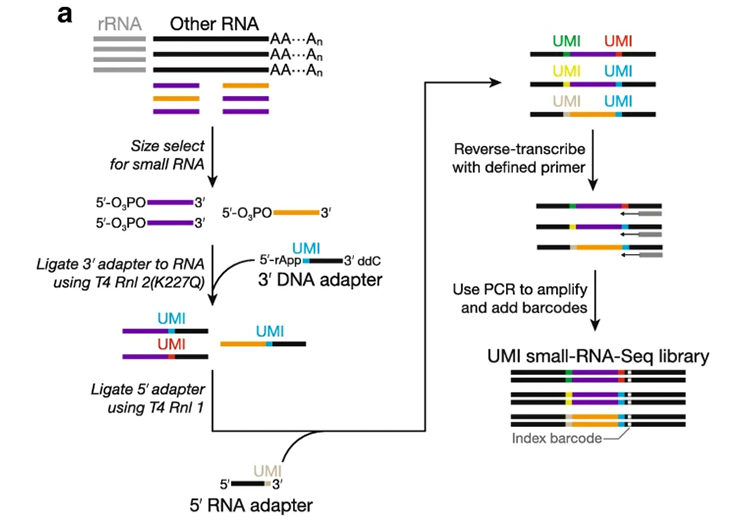
图片来源:《Elimination of PCR duplicates in RNA-seq and small RNA-seq using unique molecular identifiers》
应用:
dU是嘧啶脱氧核糖核苷,属于尿嘧啶核苷的衍生物。在细胞中dU作为dC的脱氨产物产生,脱氨过程由AID酶催化。尿嘧啶DNA糖基化酶可以水解单链DNA或双链DNA中dU的糖苷键,释放尿嘧啶,产生缺碱基位点。使得寡核苷酸链容易断裂。
1)在qPCR中,dU可防污染:通过将PCR中的dT替换为dU,qPCR检测完成后,可使用尿嘧啶DNA糖基化酶将PCR产物降解,从而避免每次PCR之间造成的交叉污染。
2)有研究将dU掺入到探针中,用来进行短DNA片段的qPCR检测:将短DNA作为引物,含dU的探针作为模板,使短DNA片段进行延伸得到一个适合进行常规qPCR的长片段,再用尿嘧啶DNA糖基化酶将含dU的探针消化避免对后续qPCR的干扰,最终设计引物对包含短DNA的长片段进行qPCR检测[13]。
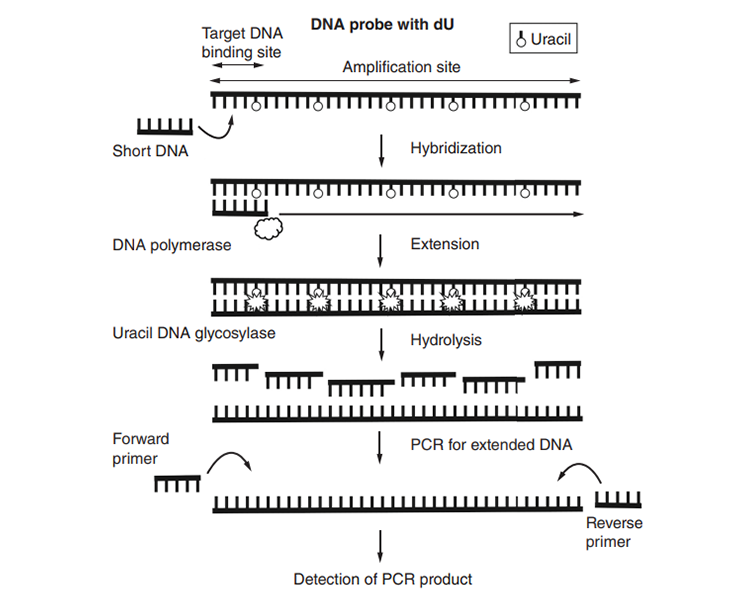
图片来源:《Real-time PCR method for detection of short DNA using a deoxyuridine probe and application for detection of fomivirsen》
应用:
dI即脱氧肌苷,属于核苷类似物,它在结构上类似鸟嘌呤脱氧核糖核苷酸,但碱基上缺少2-氨基;脱氧肌苷和A、T、C、G四种碱基均以两个氢键进行互补配对,因此脱氧肌苷经常被用作通用碱基。但是,脱氧肌苷对于A、T、C、G的结合能力存在差异,从热力学稳定性上I-C > I-A > I-G ≈ I-T,这种热力学的差异也会受到邻近碱基的影响。
1)在用混合引物进行PCR做突变时,为了考虑简并密码子的问题,经常需要设计很多引物,将dI添加到寡核苷酸密码子的第三位(摆动碱基),可以降低引物的复杂度。
2)在Dual priming oligonucleotide system(DPO,双引物寡核苷酸系统)的PCR中,dI以poly dI的形式起到linker作用。DPO系统的引物由三部分组成,较长片段的5’端序列Tm值较高,优先与靶标序列结合,稳定DPO引物与靶标退火步骤;继而较短片段的3’端结合至靶标序列上,启动特异性延伸;而连接5’和3’端的Poly-dI linker在引物退火过程中,会形成泡状结构,该探针通过使引物两步退火,确保引物启动特异性扩增[14]。
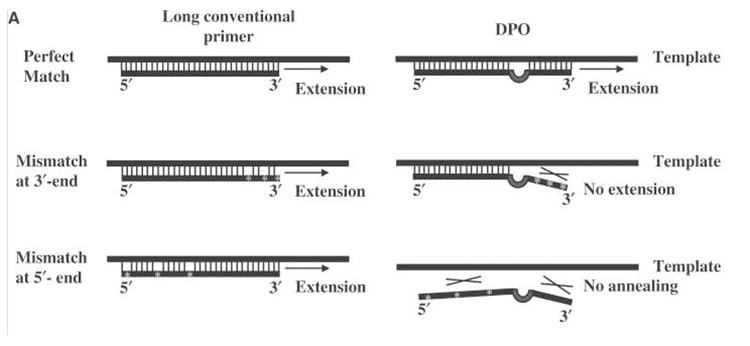
图片来源:《Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene》
应用:
rI在结构上类似鸟嘌呤核糖核苷酸,但碱基上缺少2-氨基;rI与A、U、C、G四种碱基进行互补配对。
在tRNA中rI存在于反密码子的摆动位置,这种修饰扩充了tRNA可识别的三联体密码子;在mRNA转录时或转录后可发生A-I的编辑,这种修饰影响了RNA的剪切和翻译;rI对mRNA和tRNA功能的综合作用使其成为翻译效率和准确性的主要调节剂,有助于物种间蛋白质组的多样性。
应用:
通过在寡核苷酸中引入inverted dT,寡核苷酸可以被设计成5′-5’或3′-3’连接。由于很多核酸酶作用于5′-3’磷酸二酯键,所以在寡核苷酸末端引入inverted dT可以抵抗核酸外切酶的降解。
安升达可提供各类特殊寡合苷酸合成服务,产品质量经过多年市场检验。除常规的技术支持外,专业的研发及支持团队也可提供更多个性化的解决方案。
参考文献:
[1] Niemietz, C., Chandhok, G., & Schmidt, H. (2015). Therapeutic Oligonucleotides Targeting Liver Disease: TTR Amyloidosis. Molecules (Basel, Switzerland), 20(10), 17944–17975.
[2] Ng, E. W., Shima, D. T., Calias, P., Cunningham, E. T., Jr, Guyer, D. R., & Adamis, A. P. (2006). Pegaptanib, a targeted anti-VEGF aptamer for ocular vascular disease. Nature reviews. Drug discovery, 5(2), 123–132.
[3] Muhonen, P., Tennilä, T., Azhayeva, E., Parthasarathy, R. N., Janckila, A. J., Väänänen, H. K., Azhayev, A., & Laitala-Leinonen, T. (2007). RNA interference tolerates 2′-fluoro modifications at the Argonaute2 cleavage site. Chemistry & biodiversity, 4(5), 858–873.
[4] Hendel, A., Bak, R. O., Clark, J. T., Kennedy, A. B., Ryan, D. E., Roy, S., Steinfeld, I., Lunstad, B. D., Kaiser, R. J., Wilkens, A. B., Bacchetta, R., Tsalenko, A., Dellinger, D., Bruhn, L., & Porteus, M. H. (2015). Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells. Nature biotechnology, 33(9), 985–989.
[5] Meister, G., Landthaler, M., Dorsett, Y., & Tuschl, T. (2004). Sequence-specific inhibition of microRNA- and siRNA-induced RNA silencing. RNA (New York, N.Y.), 10(3), 544–550.
[6] Robbins, M., Judge, A., Liang, L., McClintock, K., Yaworski, E., & MacLachlan, I. (2007). 2′-O-methyl-modified RNAs act as TLR7 antagonists. Molecular therapy: the journal of the American Society of Gene Therapy, 15(9), 1663–1669.
[7] Rüger, J., Ioannou, S., Castanotto, D., & Stein, C. A. (2020). Oligonucleotides to the (Gene) Rescue: FDA Approvals 2017-2019. Trends in pharmacological sciences, 41(1), 27–41.
[8] Latorra, D., Campbell, K., Wolter, A., & Hurley, J. M. (2003). Enhanced allele-specific PCR discrimination in SNP genotyping using 3′ locked nucleic acid (LNA) primers. Human mutation, 22(1), 79–85.
[9] Iyer, L. M., Zhang, D., & Aravind, L. (2016). Adenine methylation in eukaryotes: Apprehending the complex evolutionary history and functional potential of an epigenetic modification. BioEssays : news and reviews in molecular, cellular and developmental biology, 38(1), 27–40.
[10] Lebedev, Y., Akopyants, N., Azhikina, T., Shevchenko, Y., Potapov, V., Stecenko, D., Berg, D., & Sverdlov, E. (1996). Oligonucleotides containing 2-aminoadenine and 5-methylcytosine are more effective as primers for PCR amplification than their nonmodified counterparts. Genetic analysis: biomolecular engineering, 13(1), 15–21.
[11] Henry, S., Stecker, K., Brooks, D., Monteith, D., Conklin, B., & Bennett, C. F. (2000). Chemically modified oligonucleotides exhibit decreased immune stimulation in mice. The Journal of pharmacology and experimental therapeutics, 292(2), 468–479.
[12] Fu, Y., Wu, P. H., Beane, T., Zamore, P. D., & Weng, Z. (2018). Elimination of PCR duplicates in RNA-seq and small RNA-seq using unique molecular identifiers. BMC genomics, 19(1), 531.
[13] Harikai, N., Tanaka, Y., Miyashita, S., Zaima, K., & Shinomiya, K. (2022). Real-time PCR method for detection of short DNA using a deoxyuridine probe and application for detection of fomivirsen. BioTechniques, 73(6), 281–287.
[14] Chun, J. Y., Kim, K. J., Hwang, I. T., Kim, Y. J., Lee, D. H., Lee, I. K., & Kim, J. K. (2007). Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene. Nucleic acids research, 35(6), e40.
