一文了解慢病毒的应用全场景—基因传递工具
慢病毒是以HIV-1发展起来的一种病毒载体。在数十年的应用中,慢病毒也不断地优化了其生物安全性和有效性,目前已经成为体内外生物实验中一种功能非常强大的基因传递工具。在基因传递方面,慢病毒拥有其诸多独特的优势:稳定持久表达、可感染多种类型细胞、可携带大片段基因、免疫原性比较低及不易诱发宿主免疫反应等。无论是基础科研还是临床研究,慢病毒载体都具有非常广泛的应用前景。今天,小编为大家总结了近些年来慢病毒的应用热点。
RNA干扰研究
RNAi,即RNA干扰,是生物进化中产生的一种基因沉默,利用双链RNA诱发同源mRNA降解的一种现象。通过外源导入siRNA或双链RNA,可以抑制对应基因的表达,从而进行基因的功能的相关研究的RNA干扰技术,已经成为生物学研究中的重要手段之一。与化学合成的siRNA或质粒相比,慢病毒介导的RNA干扰,具有可感染多种类型细胞,可实现稳定持久的基因沉默等优势。
研究人员采用慢病毒介导的RNA干扰系统,研究STAT3(信号转导及转录激活蛋白3)信号通路对胰腺癌细胞侵袭的影响。靶向STAT3的干扰慢病毒,侵染SW1990细胞后,成功的实现了STAT3基因沉默,而STAT3表达的下降,也导致了与肿瘤侵袭和转移相关的MMP-2和VEGF蛋白的表达量下降,最终降低了胰腺癌细胞的侵袭能力。这一研究表明STAT3是胰腺癌治疗的一个潜在的靶点[2]。
A
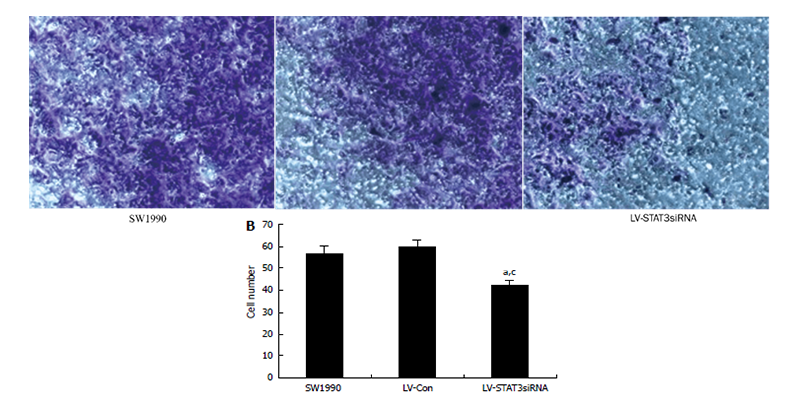
Invasionassay was performed using a specialized invasion chamber(YangG et al,World J Gastroenterol,2009)
CRlSPR/Cas9 gRNA文库筛选
CRlSPR/Cas9 gRNA文库筛选,又叫高通量基因编辑技术,是利用CRlSPR/Cas9技术建立的动物全基因组或某类相关基因的gRNA文库,通过慢病毒侵染方式导入目的细胞,对细胞进行编辑,然后功能性筛选和富集细胞,通过NGS测序和生信分析的手段,筛选出具有特定功能的基因。gRNA文库筛选技术,具有高效、精准、高通量等特点,目前已经被广泛应用到疾病研究、药物开发以及功能基因筛选等领域。而在该技术中,为了实现高效稳定的基因编辑,通常使用慢病毒作为sgRNA文库导入细胞的主要工具,实现在细胞基因组水平上的基因编辑。
有研究报道,使用慢病毒载体将靶向18080个基因的sgRNA文库导入人黑色素瘤细胞A375,通过肿瘤抑制剂PLX药筛富集,最终筛选出与肿瘤细胞耐药性相关的NF1、MED12、NF2、CUL3、TADA2B和TADA1六个基因[3]。
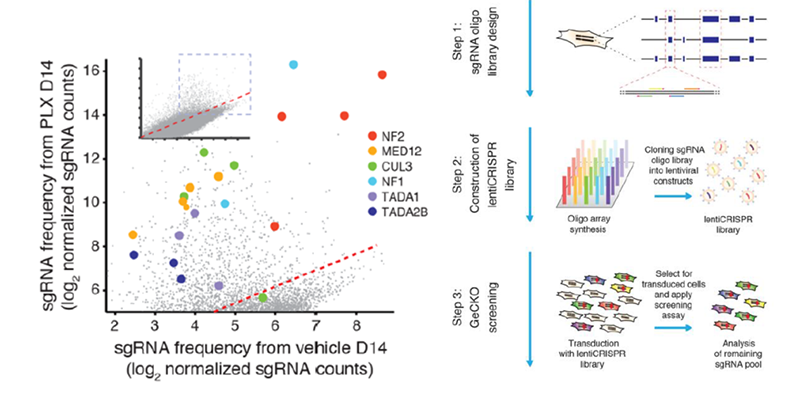
GeCKOscreen in A375 melanoma cells reveals genes whose loss confersvemurafenib (PLX) resistance.( Shalem O et al,Science,2013)
稳转细胞株构建
转细胞株,是通过某种技术手段对基因进行修饰而获得的细胞株。这种修饰可以是插入外源基因进行过表达,也可以是对内源基因表达进行干扰、敲除或突变等。与瞬时转染相比,稳转株的构建,可以让细胞持久稳定的保持这种修饰,便于实验的长期可重复性。而慢病毒由于其高效整合,宿主范围广可应用到各种类型细胞中等特点,目前已成为哺乳动物稳转细胞株构建中应用十分广泛的基因转移载体。使用慢病毒构建稳转株的基本流程包括:慢病毒包装、病毒侵染目的细胞、特定标记筛选细胞、稳转株鉴定等。除了用于重组蛋白真核表达和抗体生产,稳转细胞株也被应用到药物筛选及药理学研究等方面。
重症肌无力患者目前最灵敏的检测方法是使用CBAs或RIPA检测AChR抗体。目前临床应用上检测方法是采用AChR相关蛋白表达质粒瞬转HEK293细胞后进行检测。而这种方法耗时,成本高且批次间稳定性差。研究人员为了优化这一检测技术,采用慢病毒转染HEK293细胞构建了KL525细胞系,使其稳定过表达AChR蛋白亚基和其聚集蛋白rapsyn。经检测发现,该细胞系蛋白表达水平在15代以内没有差异,且在CBA检测中表现出更高的灵敏度[4]。

Detectionof AChR in patients with myasthenia gravis.( Cai Y et al ,FrontImmunol,2021)
转基因动物
通过某种技术手段,将外源基因插入动物生殖细胞基因组,并获得这种基因的特性,产生出能够正常繁衍的动物,即转基因动物。转基因动物一直是基础研究和临床实验的一个重要工具。早期转基因技术主要采用显微原核注射法,但这种方法价格昂贵,整合比较随机且效率很低。而利用慢病毒能够感染非分裂细胞、实现高效基因整合且不容易发生基因沉默等优点,一些研究采用慢病毒将基因导入胚胎干细胞或早期胚胎,成功制备出转基因鸡、鼠、猪等动物。
另有研究利用雄性生殖细胞成功制备了转基因小鼠。他们使用慢病毒将GFP荧光基因转导入小鼠精子细胞。然后将载有外源基因的小鼠精子通过体外受精,形成受精卵,再通过胚胎移植导入母鼠体内。结果显示,产生的42%的幼鼠携带GFP基因,对小鼠不同组织进行切片检测,GFP荧光基因可以稳定的遗传到第三代转基因小鼠。这一实验也说明了,采用慢病毒介导的基因传递是一种十分高效且稳定的转基因方法[5]。
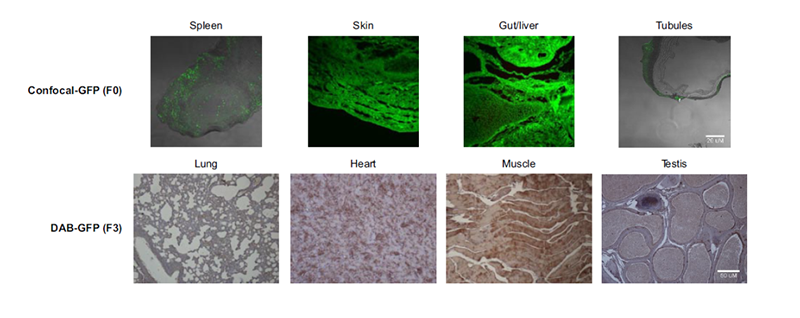
GFPexpression from transgenic F0 mice and F3 generation.(ChandrashekranA et al, FASEBJ.2014)
活体细胞成像追踪技术
活体成像技术,是将荧光或与生物发光相关的基因导入体内,利用荧光成像技术,直接可以监测体内的细胞活动等生物行为的一门技术。例如在癌细胞中,可以利用报告基因检测肿瘤细胞的增殖和转移;在干细胞中,可以追踪细胞的分化过程。因此活体成像技术在肿瘤研究、药物开发等领域均具有非常好的应用前景。该技术操作中,基因转染所使用的载体包括病毒载体和非病毒载体。与脂质体等非病毒载体相比,慢病毒具备可感染多种组织细胞、免疫原性低以及表达稳定等优势,是研究者们比较青睐的转染工具。
恶性间皮瘤,是一种预后比较差且高度侵袭性的肿瘤,急需新的治疗方式的出现。而在肿瘤治疗研发中,开发一种可以进行荧光成像的恶性间皮瘤动物模型,用于新药效果测试追踪是十分必要的。研究人员使用慢病毒将mcherry荧光基因导入该肿瘤细胞,然后将培养的细胞注射到小鼠体内,成功的建立了可以进行荧光成像追踪的人恶性间皮瘤的成像小鼠模型。通过荧光成像技术,监测mcherry荧光,可以追踪肿瘤细胞在小鼠体内的传播和微转移,可用于肿瘤的药物治疗效果追踪[6]。
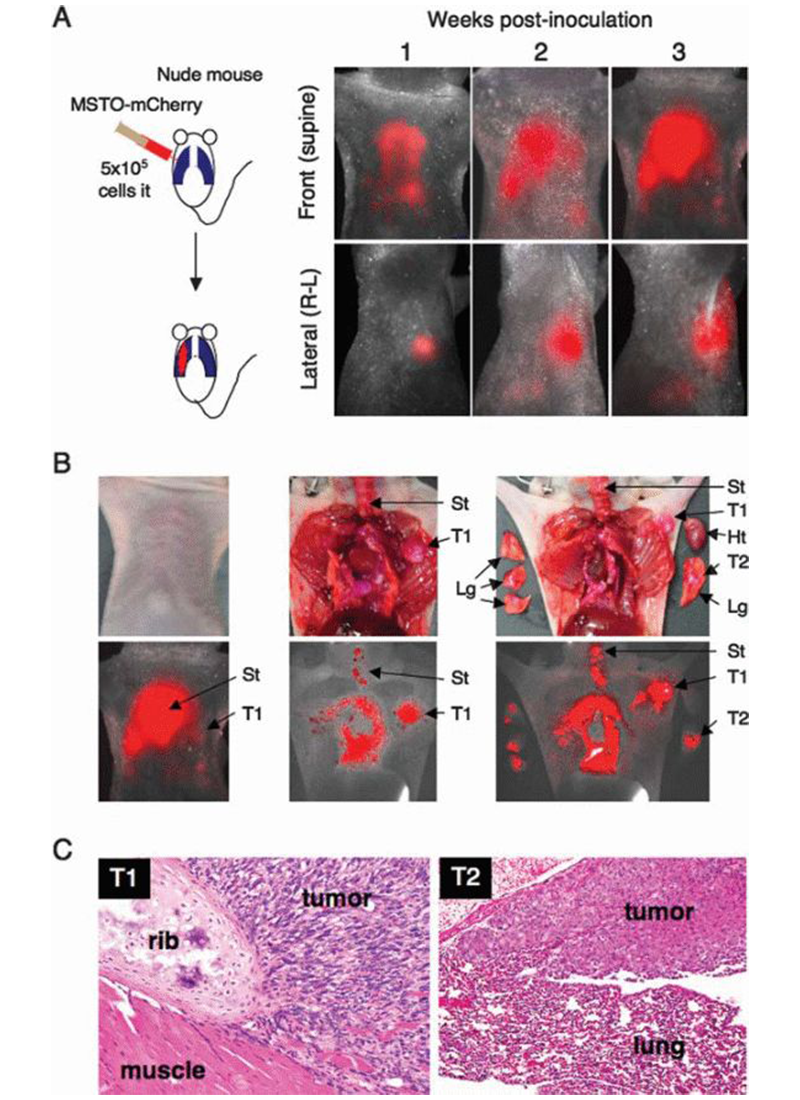
Whole-bodyfluorescence imaging in an intraperitoneal mesotheliomaxenotransplant model.(Yamaoka N et al, IntJ Oncol.2010)
神经系统科学
神经系统相关疾病的治疗,在医学发达的今天依旧有很多难题。许多研究者在开展与之相关的基础和临床研究。随着慢病毒的广泛应用,科学家们发现,慢病毒能够高效感染神经细胞,实现基因的稳定表达,且不会影响细胞功能,不会引起机体明显的免疫反应,十分适合运用到神经系统机制的研究以及疾病治疗中。目前使用慢病毒介导的老年痴呆、帕金森、运动神经元受损等疾病动物模型治疗的研究均取得了良好的效果。因此,慢病毒是神经系统疾病研究和基因治疗的非常有潜力的基因转移载体之一。
创伤性脑损伤的治疗,周期漫长、费用较高且效果不是很好。而神经生长因子(NGF)和脑源性神经营养因子(BDNF)是具有修复神经系统损伤的功能的。LinY等研究人员制备携带NGF-GFP融合基因的慢病毒载体,将其直接注射到脑损伤大鼠的海马部位。转导的融合基因蛋白持续表达了四周以上,且NGF的表达可诱导神经元样细胞突触生长,且保护细胞免受氧化损伤,这些结果表明慢病毒介导的NGF转导能够挽救大鼠脑损伤[7]。
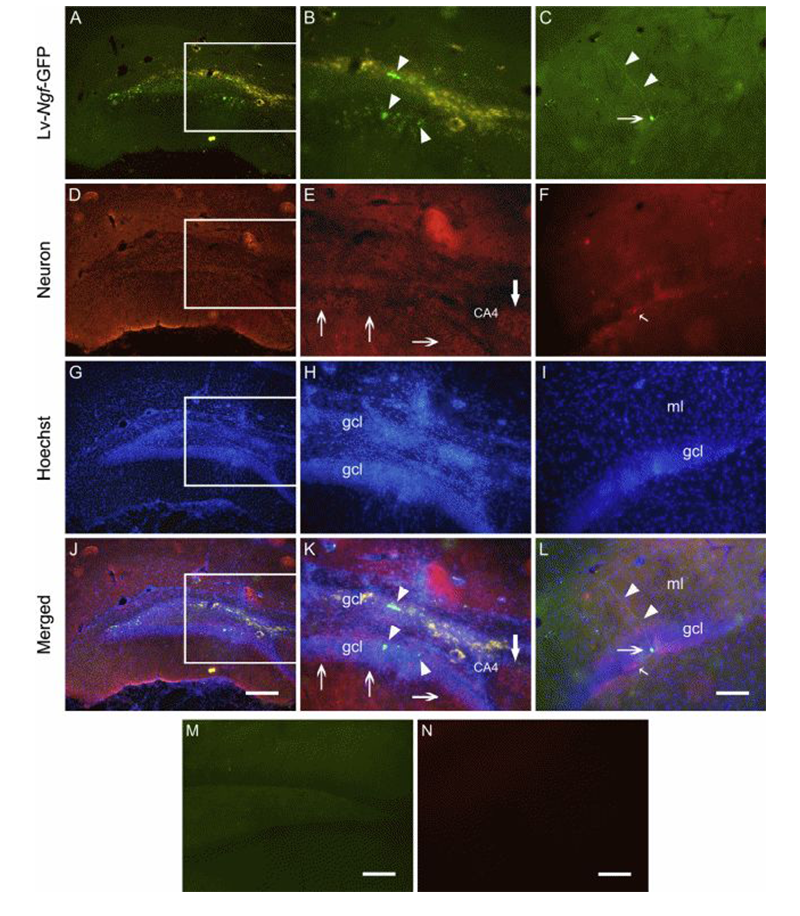
Locationof the pseudo lentivirus-delivered b-Ngf fusion gene expression afterits injection in the injured brain(LinY, et al. Biomaterials.2015)
安升达慢病毒相关服务
安升达慢病毒生产平台,具备BSL-2级实验室资质,拥有专业的技术团队,采用行业公认的标准生产流程,为客户提供优质的服务。安升达分子生物学平台和细胞生物学平台相结合,可以为满足客户病毒相关实验的各种需求,不仅可以提供从基因合成或文库构建到病毒包装整个流程的一站式服务,也可为客户提供稳转细胞株构建、KO/KI细胞株构建、CRlSPR/Cas9gRNA文库筛选以及其他定制化的服务。
更多信息可咨询400-8100-669或发送邮件EditGene@Azenta.com
参考文献
[1]Sakuma T, Barry M & Ikeda Y . (2012). Lentiviral vectors: basicto translational. BiochemicalJournal,443(3), 603-618[2]Yang G, Huang C, Cao J, Huang KJ, Jiang T, Qiu ZJ.Lentivirus-mediated shRNA interference targeting STAT3 inhibits humanpancreatic cancer cell invasion. WorldJ Gastroenterol.2009;15(30):3757-3766.[3]Shalem O, Sanjana NE, Hartenian E, et al. Genome-scale CRISPR-Cas9knockout screening in human cells.Science.2014;343(6166):84-87.[4]CaiY, Han L, Zhu D, et al. A Stable Cell Line Expressing Clustered AChR:A Novel Cell-Based Assay for Anti-AChR Antibody Detection inMyasthenia Gravis.Front Immunol.2021,12:666046.[5]ChandrashekranA, Sarkar R, Thrasher A, et al. Efficient generation of transgenicmice by lentivirus-mediated modification of spermatozoa. FASEBJ.2014;28(2):569-576.[6]YamaokaN, Kawasaki Y, Xu Y, et al. Establishment of in vivo fluorescenceimaging in mouse models of malignant mesothelioma. IntJ Oncol.2010;37(2):273-279.[7]LinY, Wan JQ, Gao GY, et al. Direct hippocampal injection of pseudolentivirus-delivered nerve growth factor gene rescues the damagedcognitive function after traumatic brain injury in therat. Biomaterials.2015,69:148-157.
