mRNA疫苗这么火,来看看mRNA poly(A)质粒如何快速合成和稳定制备?
新冠爆发以来,mRNA疫苗和治疗药物研究如火如荼。mRNA疫苗,是将合成的编码蛋白质抗原的mRNA序列注入人体内,指导机体表达相应的蛋白质,并诱导机体激发特异性免疫应答,达到疾病预防和治疗的目的[1]。与传统疫苗相比,具有免疫原性强、安全性高且易研发与生产等优点。mRNA疫苗近几年如雨后春笋般涌现,目前各类mRNA疫苗在基础研究和临床研究方面都取得了突破性进展。在病毒传染病如新冠病毒、流感病毒、HIV、狂犬病病毒等、免疫肿瘤学(IO)、个性化癌症(PCV)、遗传性疾病和罕见疾病等领域的应用。
根据遗传特征,mRNA可分为非复制型mRNA(non-replicating mRNA, NRM)和自扩增型mRNA(self-amplifying mRNA, SAM)和环状RNA(Circular RNA)。非复制型和自扩增型都有一个5’端帽子(Cap)、5’和3’非翻译区(Untranslated Region, UTR)、开放阅读框(Open Reading Frame, ORF)区和3’poly(A)尾[2]。非复制型mRNA疫苗只提供靶抗原的遗传信息编码,自扩增型疫苗还可以编码其他基因的遗传信息,例如病毒RNA聚合酶,使mRNA自我复制。在自扩增型的基础上,反式扩增型得到了优化和开发。环状RNA由于其天然的高稳定性,最近也被用于开发新冠mRNA疫苗。但目前正在临床试验或已经上市的大多数新冠 mRNA疫苗都是非复制型的[3]。

图1 mRNA的不同类型
mRNA的帽子结构可降低免疫反应促进翻译;5’UTR参与起始的调控;3’UTR参与翻译效率以及mRNA稳定性的调控;poly(A)尾的长短和翻译效率以及mRNA的稳定性有关[4]。
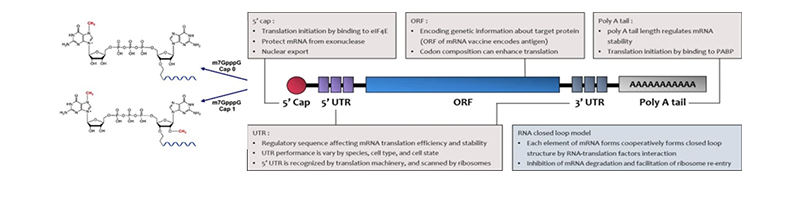
图2 mRNA疫苗组件的结构
mRNA疫苗整体生产流程包括质粒原液生产、mRNA原液生产、mRNA制剂制备与纯化、质检及储存运输等。技术步骤主要包括:序列设计、体外转录、递送系统装载。mRNA疫苗壁垒主要在于序列设计和递送系统,但避免生产过程中mRNA poly(A)尾的丢失也至关重要。
mRNA poly(A)尾的生理功能
- 维持mRNA的稳定性:poly(A)尾巴对mRNA的成熟发挥着至关重要的作用,它可以保护mRNA不被降解,增加RNA的稳定性,提高翻译效率。不同长度的poly(A)序列能不同程度地影响mRNA的翻译效率。poly(A)尾的长度一般是100-250个核苷酸,在人T细胞中是300个核苷酸[5] 。
- 调节mRNA的翻译效率:poly(A)尾的长度决定了mRNA翻译的程度,poly(A)尾的缩短和延长可以很好地反映poly(A)尾巴在时间和空间上对基因表达的调控。
- 维持mRNA的运输:转录本上存在适度长度的poly(A)尾巴是mRNA出核的身份认证,即使去除poly(A)尾后的转录本太短,表现地不像mRNA,这表明poly(A)尾巴可以增加RNA长度,又能充当特异性募集mRNA出核因子的平台[6]。
poly(A)结合蛋白(PABP)可以通过翻译起始因子eIF4G和eIF4E与5’cap相互作用,形成一个闭环结构,协同参与调节mRNA的稳定性及翻译活性[7]。Lima及其同事最近的研究显示,较短的poly(A)序列可以促进这种闭环结构的高效翻译[8] 。
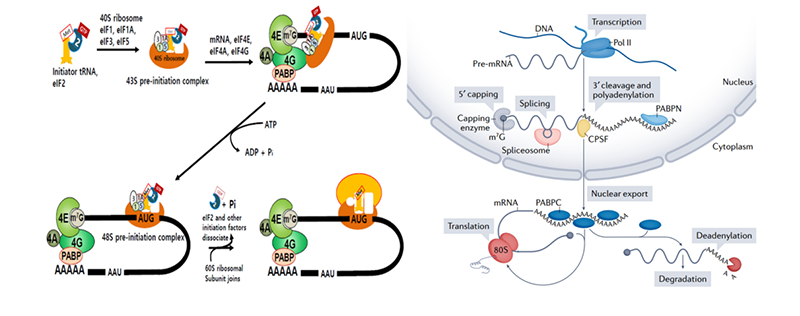
图3 mRNA翻译的启动
体外mRNA poly(A)尾的加尾方法
通过IVT合成mRNA时,poly(A)尾的添加方式主要有:一是酶法合成,mRNA转录完成后添加源自大肠杆菌的poly(A)聚合酶;二是共转录,由已经存在于模板质粒DNA或者PCR产物上的poly(A)序列直接转录形成;三是使用使用phi29 DNA聚合酶,体外滚环扩增(RCA)技术扩增质粒。共转录加尾能保持终产物的同质性,减少工艺步骤,节约成本,成为大家更偏好的方法[8]。也有些科学家另辟蹊径,选用分段式的poly(A)共转录法,它可以降低poly(A)的缺失。基于闭环模型,我们知道,每个poly(A)结合蛋白PABP只占据约30个A,两个结合蛋白之间有少量A充当了间隔序列,如果把间隔序列用其他序列替代,发现poly(A)发生重组缺失的情况变低。对间隔序列的长度和碱基偏好进行研究,科学家甚至找到了更优质的间隔序列。而这些都说明这种间隔序列的设计方式更具有优势[9]。

图4 分段式poly(A)的加尾方式
mRNA质粒制备通常选择细菌发酵方式进行规模化生产质粒,但在细菌扩增过程中,携带长的聚均核苷酸序列的质粒的poly(A)尾巴可能会随着细菌的不断扩增发生缩短,且质粒上poly(A)序列大于120bp时更容易在培养过程中不稳定然后发生丢失缩短问题,且30℃培养条件下,细胞生长变慢,质粒拷贝数降低,产量减少,对生产造成困难。
为此,Azenta 建立一套新的mRNA质粒构建和制备流程,能够稳定生产带有固定长度poly(A)尾巴的mRNA质粒,帮助mRNA疫苗及药物研发的客户改善其mRNA质粒生产工艺,为后续实验的安全性保驾护航。
结果展示
Azenta 对poly(A)序列长度小于150bp的mRNA质粒制备的生产工艺流程进行优化。如图所示,与原常规流程相比,无论是poly(A)序列小于120bp还是大于120bp,poly(A)流程(PF)取得更好结果。不同poly(A)序列长度质粒的原始菌液分别放置1d、10d,进行扩大培养后,poly(A)流程质粒产量始终比常规流程高。poly(A)流程随着菌液放置的时间变长,产量下降趋势没有原流程明显(图5)。
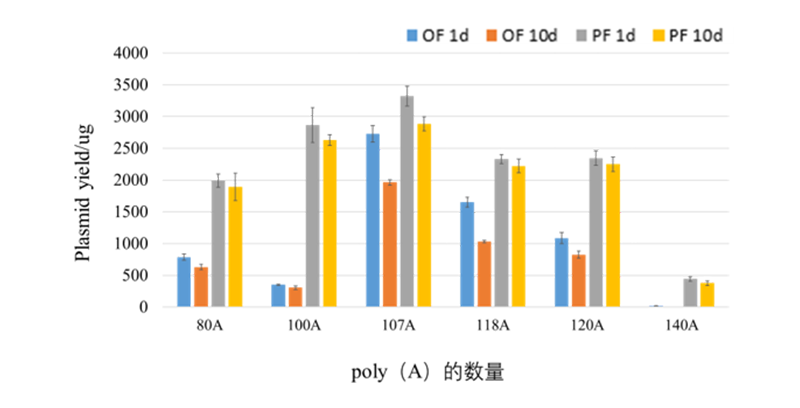
图5 不同poly(A)序列长度质粒的产量(Mega规格)
优化后的流程不仅能提高质粒产量,而且同时能更好的保持poly(A)尾在细菌培养过程中的稳定。尤其是保持了120bp≤poly(A)序列<150bp的质粒在培养扩增过程中的稳定,不同poly(A)序列长度质粒的原始菌液放置10d后的大抽质粒poly(A)序列仍没有丢失缩短,有效解决poly(A)序列的易丢失造成poly(A)尾缩短的问题,实现生产poly(A)序列同质性的优质质粒模板(图6)。
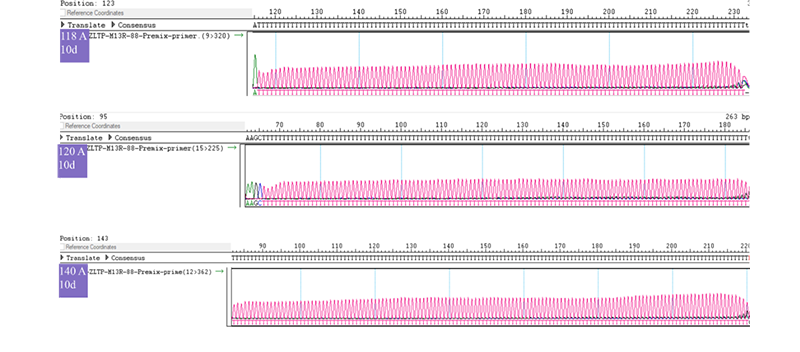
图6 不同poly(A)序列长度质粒的poly(A)测序(Mega规格)
poly(A)质粒制备案例分享
案例一(75A):常规流程时组内得到1个小抽质粒测序正确的克隆(Stbl3),30℃摇大瓶大抽后的质粒poly(A)又缺失了。但使用poly(A)流程进行质粒制备,37℃摇大瓶大抽质粒poly(A)未丢失。
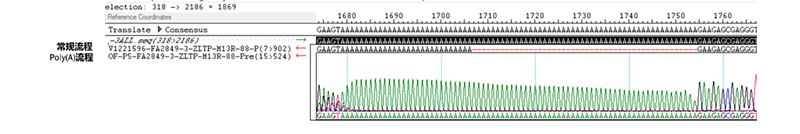
图7 常规流程与poly(A)流程的poly(A)对比测序图(75个poly(A))
案例二(121A、140A):常规流程,组内得到1个小抽质粒测序正确的克隆(Stbl3),30℃培养条件下,大抽质粒poly(A)一直缺失。但使用poly(A)流程进行质粒制备,37℃条件下培养,大抽质粒poly(A)未丢失。

图8 常规流程与poly(A)流程的poly(A)对比测序图(121、140个poly(A))
发货产物交货标准

结语
mRNA疫苗正被广泛应用于医疗领域,对质粒原液的生产制备需求与日俱增。由于整个下游纯化过程工艺路线复杂,收率仅约30~40%,这造成上游需要生产更多产量和纯度高的mRNA质粒,而质粒模板制备便是mRNA技术中最上游的部分。在上游mRNA质粒制备过程中,减少培养过程中poly(A)序列的重组及缩短,为客户的下游工艺提供高产优质且均一性好的质粒模板是我们追求的目标。
以上为本次分享的全部内容,如需了解更多信息,欢迎随时联系我们,我们将竭诚为您服务!
关于安升达基因合成
安升达拥有一站式基因分析设计平台,基因合成完成率达99.9%,仅需提交核苷酸或氨基酸序列,就能够轻松地合成(自然界)已存在的序列、经密码子优化后的序列、特殊位点突变的基因、人工设计的DNA序列,基因突变文库以及研究所需的其他序列。针对不同的合成长度和基因合成不同的应用方向,安升达可提供个性化的合成方案。
参考资料
[1] Uchida S, Perche F, Pichon C, Cabral H. Nanomedicine-Based Approaches for mRNA Delivery. Mol Pharm. 2020, 17(10):3654-3684.
[2] Ssr A, Dmfp A, Ama A, et al. mRNA vaccines manufacturing: Challenges and bottlenecks[J]. Vaccine, 2021, 39(16):2190-2200.
[3] Fang, E., Liu, X., Li, M. et al. Advances in COVID-19 mRNA vaccine development. Sig Transduct Target Ther 7, 2022, 94.
[4] Kwon, S., Kwon, M., Im, S. et al. mRNA vaccines: the most recent clinical applications of synthetic mRNA. Arch. Pharm. Res. 2022, 45, 245–262.
[5] Holtkamp S, Kreiter S, Selmi A, et al. Modification of antigen-encoding RNA increases stability, translational efficacy, and T-cell stimulatory capacity of dendritic cells[J]. Blood, 2006, 108(13):4009-17.
[6] Hiroyuki, Fuke, Mutsuhito, et al. Role of poly (A) tail as an identity element for mRNA nuclear export[J]. Nucleic acids research, 2008, 36(3):1037-49.
[7] Miao L, Zhang Y, Huang L. mRNA vaccine for cancer immunotherapy[J]. Molecular Cancer, 2021, 20(1).
[8] Lima S, Chipman L, Nicholson A, et al. Short poly(a) tails are a conserved feature of highly expressed genes[J]. Nat Struct Mol Biol. 2017, 24(12):1057–63.
[9] Trepotec Z, Geiger J, Plank C, Aneja MK, Rudolph C. Segmented poly(A) tails significantly reduce recombination of plasmid DNA without affecting mRNA translation efficiency or half-life. RNA. 2019, 25(4):507-518.
