治疗性抗体的发展历程
1986年,全球第一个治疗性单克隆抗体药物OKT3(muromonab-CD3)获得美国FDA批准,这35年来随着抗体工程技术的极大发展,目前FDA批准的抗体药物数量已经达到100多款。
治疗性抗体已成为近年来新药开发的主要类别。在过去五年中,抗体也成为医药市场上最畅销的药物。2018年,全球治疗性单克隆抗体市场价值约1152亿美元,预计到2025年将产生3000亿美元的收入。随着新药被批准用于治疗各种人类疾病,包括癌症、自身免疫、代谢和传染病,治疗性抗体药物的市场经历了爆炸性增长。
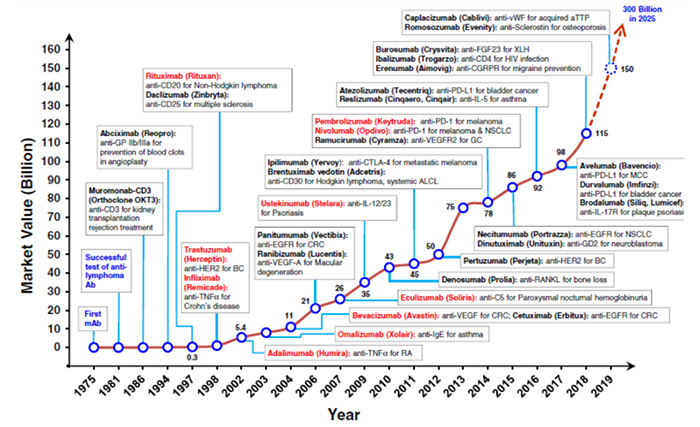
图1.1975年开始治疗性抗体及其应用的开发时间表
这里小编给大家推荐这篇2020年发表的综述,文章总结了抗体药的市场趋势,概述了五个主要的用于治疗性抗体药开发的抗体工程技术,包括人源化单克隆抗体、噬菌体展示、转基因小鼠、单B细胞抗体技术和抗体亲和力成熟等。随小编一起来回顾下吧。

图2.开发治疗性抗体的方法
抗体发现平台一:杂交瘤技术
鼠源单抗(momab)
(1)单克隆抗体技术的诞生
1975年Kohler和Milstein发现将小鼠骨髓瘤细胞与绵羊红细胞免疫的小鼠脾细胞进行融合,形成的杂交瘤细胞既可产生抗体,又可无限繁殖,从而创立了单克隆抗体杂交瘤技术。
后期通过克隆化可得到来自单个杂交瘤细胞的单克隆系,即杂交瘤细胞系,它所产生的抗体是针对同一抗原结合位点的抗体,即单克隆抗体(monoclonal antibody),简称单抗。
(2)鼠源单抗的缺点
小鼠杂交瘤技术最初产生的抗体序列都是鼠源的,这导致未人源化鼠单克隆抗体作为治疗有几个缺点:(a)排斥反应。人体会将鼠源抗体蛋白识别为异体抗原,这样使用小鼠单克隆抗体治疗的患者将产生快速的人抗鼠抗体(HAMA)反应;(b)人抗鼠抗体(HAMA)反应会加速清除小鼠单克隆抗体,还可能产生不良的过敏反应和肿瘤渗透;(c)由于Fc段为鼠源性的,患者产生抗体依赖的细胞介导的细胞毒性作用(ADCC)的能力受限。
由于鼠源单抗的诸多限制性,目前仅开发上市过两款鼠源单抗药,一个是1986年批转上市的Orthoclone OKT3单抗药,用于防止肾脏移植后的宿主排斥;一个是2002年批准上市的Zevalin单抗药,用于治疗非霍奇金淋巴瘤。
为了解决鼠抗体的免疫原性问题,人源化单克隆抗体能够有效解决以上问题,因此人鼠嵌合单抗(ximab)和人源化单抗(zumab)出现了。
人鼠嵌合单抗(ximab)
嵌合抗体中用人恒定区代替了鼠抗体的恒定区(如图3b),这样的重组抗体可以降低鼠源抗体的免疫原性。1984年Morrison等首次报道从杂交瘤细胞中获得鼠抗体轻、重链可变区基因,利用DNA重组技术将其插入到人抗体恒定区基因的表达载体中,转染哺乳动物细胞表达出人-鼠嵌合抗体,这开创了抗体人源化改造的先河。
1994年,美国FDA批准了第一款嵌合抗体药Reopro,它是由礼来等公司开发的,针对血管形成术中抗血栓形成的抗药。现在市场上,FDA授权的单克隆药中有8款是基于杂交瘤技术产生的基因工程技术改造后的嵌合抗体。
嵌合抗体虽然一定程度上解决了人抗鼠抗体反应(HAMA response),但其可变区中的框架区依然是鼠源的,残留一定的免疫原性可诱发HAMA反应,需要进一步优化。
人源化抗体(zumab)
我们都知道抗体的可变区由高变区(hypervariable region,HVR)和骨架区组(framework,FR)组成。高变区形成与抗原表位互补的空间构象,又被称为互补决定区(complementarity determining region,CDR)。嵌合抗体替换了鼠抗体的整个恒定区,人源化抗体做了进一步优化:杂交瘤技术获得靶向抗原的鼠抗体后,利用基因克隆及DNA重组技术将鼠抗的CDR区域和人源抗体进行重组(如图3c)。重新表达的抗体即保留了靶向目标抗原的亲和力和特异性,又大大降低了其免疫原性。
CDR移植是人源化单克隆抗体生产中最流行的技术之一,最初由Gregory P. Winter于1986年开发。CDR移植进一步减少了抗体中鼠源序列的含量,其人源性可达90%以上。2018年全球十大畅销单抗药中五个是人源化抗体,包括罗氏开发针对HER2靶点治疗乳腺癌的曲妥珠单抗,默克开发的靶向PD-1治疗的大名鼎鼎的K药帕博利珠单抗,当年销售额分别达到70亿美元和72亿美元。
人源化抗体依然有其局限性,需要重点关注的是,可变区的骨架区FR有可能协同CDR以呈现抗体结合位点的正确构象,甚至和CDR一起和抗原相互作用。人源化抗体缺失了某些原鼠源FR区的关键氨基酸残基,有可能丧失抗原亲和力,应同步移植关键氨基酸残基并进一步进行亲和力成熟以改善这种情况。同时,由于人源化单克隆抗体还是含有10%的鼠源蛋白,因而在临床应用时,不可避免的存在一些免疫排斥反应。抗体发现平台发展的最终目标是开发人源抗体,即抗体氨基酸序列100%是人源的。
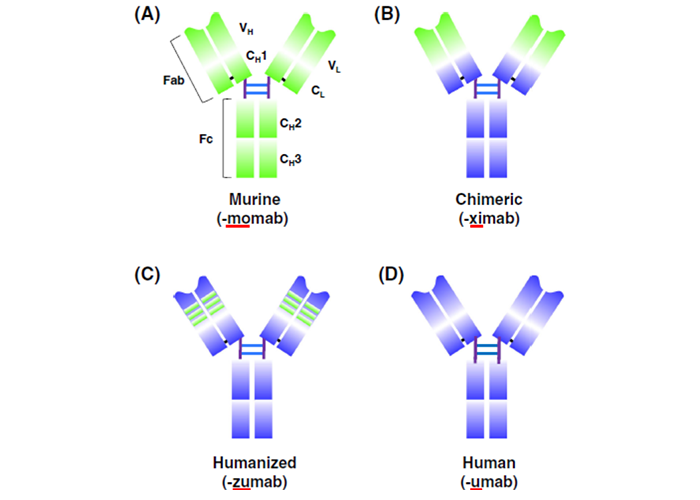
图3.鼠抗体(a)到全人源抗体(d)化示意图
全人源化单抗(mumab)
目前临床上使用的全人源治疗性抗体发现平台分别是抗体库展示技术、转基因小鼠技术、人单B细胞筛选技术。
抗体发现平台二:噬菌体展示技术
噬菌体展示技术将抗体分子DNA片段如Fab或单链抗体scFv与噬菌体外壳蛋白基因重组融合表达,融合蛋白表达于噬菌体表面,形成噬菌体抗体库,用目标抗原即可淘选出特异性和亲和力都较高的功能抗体。噬菌体展示文库将抗体表型(特异性和敏感性)和基因型(遗传信息)直接联系了起来。
构建噬菌体展示抗体库流程如图4所示,提取人外周血单个核细胞(PBMC)中的mRNA,反转录成cDNA;特异性扩增出抗体的全套可变区基因,连接到噬菌粒载体上;电转进大肠杆菌培养,大量噬菌体释放。每个噬菌体表面呈现抗体Fab片段或单链抗体scFv片断。展示在噬菌体外壳蛋白上的抗体Fab片段具有相对较高的结构稳定性,并且可以容易地转化为完整的IgG抗体,通常不会损害结合活性。由于噬菌体颗粒的小尺寸和高溶解度,可在单个文库中高效地产生和显示多达1011种克隆系。
同时,噬菌体展示技术还用于抗体的亲和力成熟成熟,基于这些技术,2002年美国FDA批准了第一款全人源治疗性抗体阿达木单抗(Humira),一种抗肿瘤坏死因子α(TNFα)人源抗体,由艾伯维公司开发的用于治疗类风湿性关节炎。目前有九种噬菌体展示衍生的人类抗体被美国FDA批准用于治疗人类疾病(附录),其中阿达木单抗(Humira)是有史以来生物制药产品销售额最高的一种,接近199亿美元。
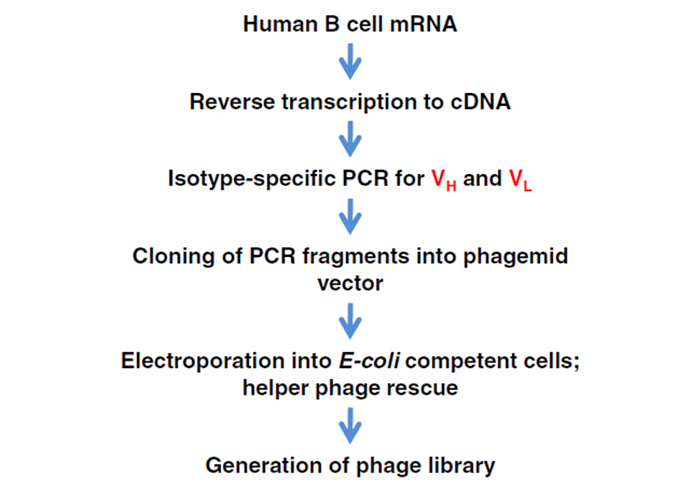
图4 构建噬菌体展示抗体库的简要流程
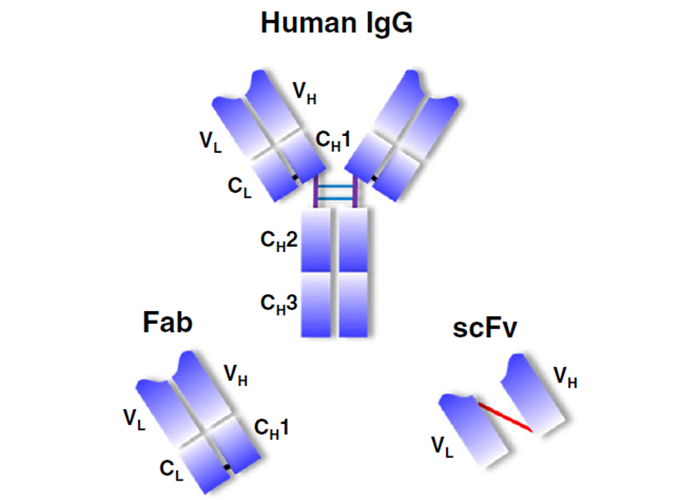
图5 IgG分子的结构
抗体发现平台三:转基因小鼠
转基因动物为抗体药的开发提供了可靠的平台,首先在小鼠胚胎干细胞中,通过基因工程手段沉默或者敲除小鼠内源抗体的可变区基因,然后将人免疫球蛋白基因在小鼠的C区域上游定点敲入,或者同源替换。这样免疫转基因小鼠后,通过制备杂交瘤即可获得全人源抗体。与其他制备人类抗体的技术相比,转基因动物具有以下优点:不需要人源化、更多样化、体内亲和力成熟以优化抗体。
目前,FDA已经批准了21款使用转基因小鼠平台开发的抗体。在转基因小鼠抗体技术的发展过程中,由于技术体系和方法有限一直深陷专利之争,从FDA批准上市的4个转基因小鼠平台来看,他们在敲除鼠内源抗体基因和导入人源抗体两个方面有细微的技术差异,但同样无可避免的是人Ig基因座非常大全部导入小鼠基因组仍是一个挑战。
抗体发现平台四:单B细胞抗体技术
使用传统方法如杂交瘤技术或转基因小鼠生产治疗性抗体需要免疫和筛选等长期过程,同时,鼠源抗体容易引发人抗鼠抗(HAMA)反应,即使经过改造甚至是全人源抗体依然可能引起抗药抗体反应,其中一个原因是成熟的B细胞在体内被抗原刺激后,会通体细胞突变进一步亲和力优化,而抗体平台开发的抗体没有体细胞突变过程。单B细胞抗体技术直接从恢复期病人体内筛选获得具有抗原特异性的B细胞,在传染病等紧急情况下,可以快速高效筛选分离潜在的单克隆抗体药。
单B细胞抗体技术的流程,首先直接从恢复期病人血浆中获得PBMC细胞,通过流式细胞技术/微流控技术/光导技术筛选出和抗原特异性结合的B细胞,然后进行单细胞分选,结合高通量测序技术获得单个B细胞的抗体轻重链可变区序列信息,可以将抗体发现周期缩短到4周左右。
现在,仍然没有美国FDA批准的基于此技术开发的治疗性单克隆抗体。单B细胞技术优势明显,几乎没有免疫原性问题,但仍有一些问题需要克服,例如,抗原标记技术、抗原选择和引物组的设计都是成功产生单克隆抗体的重要考虑因素,单B细胞可能对自身抗原敏感度低而更适合对病毒等外源靶点的筛选。
抗体药物研发技术体系比较

备注:以上抗体药信息仅总结至2020年初文献内容,请以最新信息为准
总结与展望
单克隆抗体市场正以不断加快的速度增长,仅2018年的估值就已达到1152亿美元,七家公司占据了市场主导位置,七家公司的市场份额组成为:基因泰克(30.8%)、艾伯维(20.0%)、强生(13.6%)、百时美施贵宝(6.5%)、默沙东(5.6%)、诺华(5.5%)、安进(4.9%),其余13%为其他公司。创新抗体药潜力巨大,双特异性抗体、抗体偶联药物等都是国内外抗体药物研发的新热门方向。相信未来抗体药会在癌症、自身免疫性疾病和传染病等更多疾病领域,为患者带来性价比更高的治疗方案。
*本文使用的命名系统只适用于2017年以前获批的抗体
关于安升达抗体发现服务
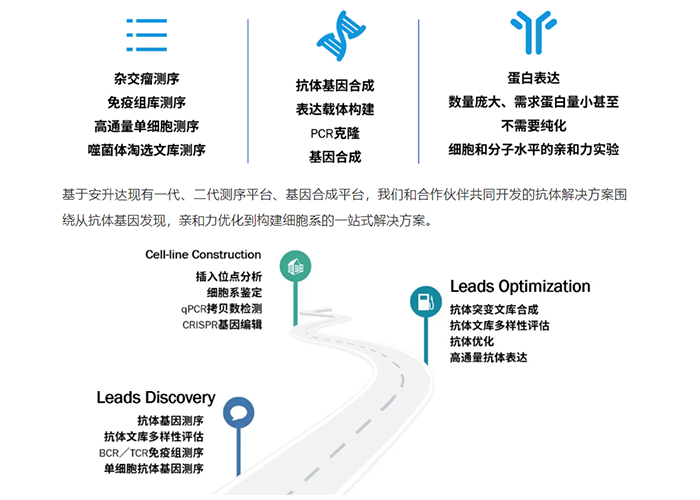
如需了解更多信息,欢迎随时联系我们,我们将竭诚为您服务!
