提高基因编辑效率,看我化学合成sgRNA
随着2021年度诺贝尔奖各大奖项陆续公布,“诺贝尔奖”的话题再次成为了网友们关注的热点。回顾近几年的诺奖,去年的化学奖,授予了法国科学家Emmanuelle Charpentier和美国科学家Jennifer A. Doudna,以表彰其“开发了一种基因组编辑的方法”,阐述和发展了CRISPR基因编辑技术,是近年来最为重要的科学进展之一。
CRISPR/Cas9技术自问世以来,迅速发展,成为生物学中的热门研究领域,现代生物学已将其广泛应用在基因编辑领域。CRISPR/Cas9技术是继锌指核酸酶(zinc-fingernuclease,ZFN)、转录激活样效应物核酸酶(transcription activator-like effector nucleases,TALENs)等技术后最为重要的基因改造技术,可以在基因敲入、基因敲除、基因激活、基因沉默、表观遗传修饰及3D基因结构改变中进行广泛的应用。早在2013年,CRISPR/Cas9技术就被《科学》列为年度十大科技进展之一,是发展最为迅猛的基因编辑技术。CRISPR/Cas9技术不仅同时靶向多个靶点,切割效率高,而且设计简单,识别不受基因组甲基化影响,适应面广,使其优势更明显。
CRISPR/Cas9技术中,crRNA(CRISPR RNA)和tracrRNA(trans-activating CRISPR RNA)起到了至关重要的作用。crRNA和trRNA是两条单链RNA,其中,crRNA由pre-crRNA剪切而来,tracrRNA由tracrRNA基因转录而来,两者具有一段互补序列,在与Cas蛋白结合后,可形成由crRNA引导的核酸内切酶复合物。有文献报道[1],当crRNA和tracrRNA被改造成一个单一的RNA后,仍然具有双链DNA的剪切功能。这种被改造后的单链RNA,就被称之为单向导RNA(single guide RNA, sgRNA)[2]。
传统的sgRNA合成方式包括质粒转染,体外转录等,但是它们制备成功率不稳定,并且有可能带来细胞毒性,在使用上有一定地局限性。而通过化学方法合成sgRNA,可以有效避免上述问题。

我们通过尿素-TBE胶、ESI-MS、体外酶切和细胞实验等方法,从化学质量及生物有效性角度分别验证了化学合成的sgRNA。
尿素-TBE跑胶结果
通过化学合成的sgRNA通过尿素-TBE跑胶结果(图1),我们可以看到sgRNA主条带清晰且单一。图中,最左端为可靠来源的60nt的RNA,右端四条为99nt的sgRNA。
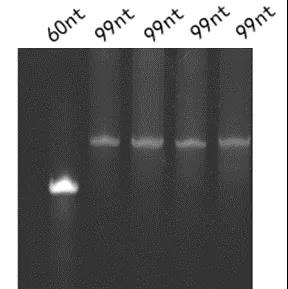
图1.99nt的sgRNA采用10%UREA-TBE变性胶进行QC结果图
ESI-MS
通过ESI-MS(图2),我们可以看到化学合成的sgRNA目标分子量单一,目标分子量为32124.2,实测分子量为32125.1,目标分子量和实际分子量偏差值≤0.05%,确认合成的RNA分子量和理论值一致。
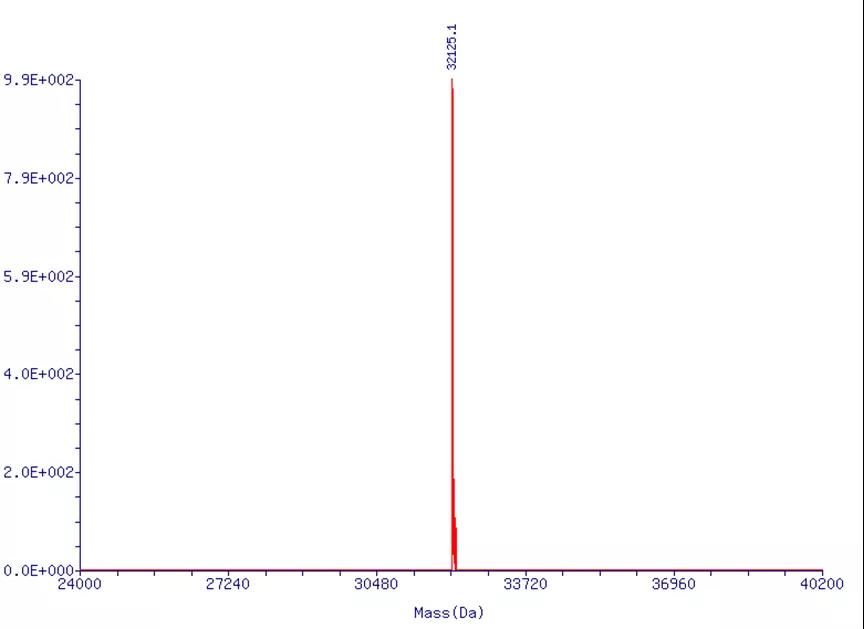
图2.100nt的sgRNA采用ESI-MS进行QC结果图
体外酶切实验
在化学质检方法过关后,我们又验证了其在生物学上的有效性。在体外酶切实验中,采用化学合成的sgRNA或crRNA:tracrRNA组合,相较于传统的体外转录的方法,拥有更好的剪切效果(图3)。

图3.不同合成方式酶切实验效果验证
此外,有文献报道[3],在sgRNA的5’和3’端各加3个硫代和甲氧基修饰,可以提高sgRNA稳定系,并降低脱靶效应。我们也通过化学方法合成了修饰后的sgRNA,进行体外酶切实验验证(图4)。其中,G2和G3表示未修饰的sgRNA序列;M2和M3表示5’和3’端各3个硫代和甲氧基修饰sgRNA序列。可以看到所合成的修饰和未修饰的sgRNA均具有体外酶切活性。
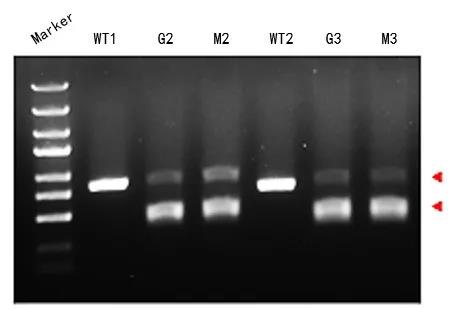
图4.化学修饰sgRNA的体外酶切实验效果验证
同时,我们还对化学合成的sgRNA进行了细胞内的基因编辑效率验证。通过对HEK293T细胞进行Cas9/sgRNA的RNP电转实验,我们对于基因组上某个序列进行了随机突变,通过分析相应的sanger测序结果(图5),我们可以看到电转RNP的编辑效率(G)要高于电转质粒(P)的效果;而在sgRNA经过化学修饰后(M),编辑效率还能够进一步提升,效率接近100%。
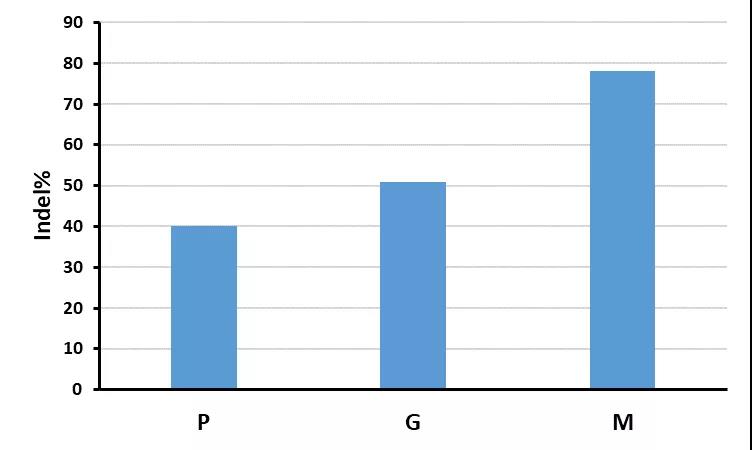
图5.化学修饰sgRNA的细胞基因编辑实验效果验证
以上数据表明,通过化学方法合成sgRNA,纯度更高,可以有效避免其他核苷酸杂片段的干扰;其编辑效率相比传统的体外转录或质粒表达等方法也更为高效;而经过化学修饰后,sgRNA变得更加稳定,能够进一步提高基因编辑效率。
在众多基因编辑技术中,CRISPR/Cas9目前还是有着简单易用等不可替代的优势。许多实验室,公司及临床项目已经开始对CRISPR/Cas9技术进行应用,比如:利用其进行信号通路相关基因的寻找,药物靶点筛选,药物原发性研究以及基因治疗等。相信未来几年,CRISPR/Cas9技术依旧会热度不减,并往更深入的方向发展。
安升达拥有多年的寡核苷酸合成经验,可以合成长达110nt的RNA(图6),规格多样,满足客户需求。欢迎咨询!
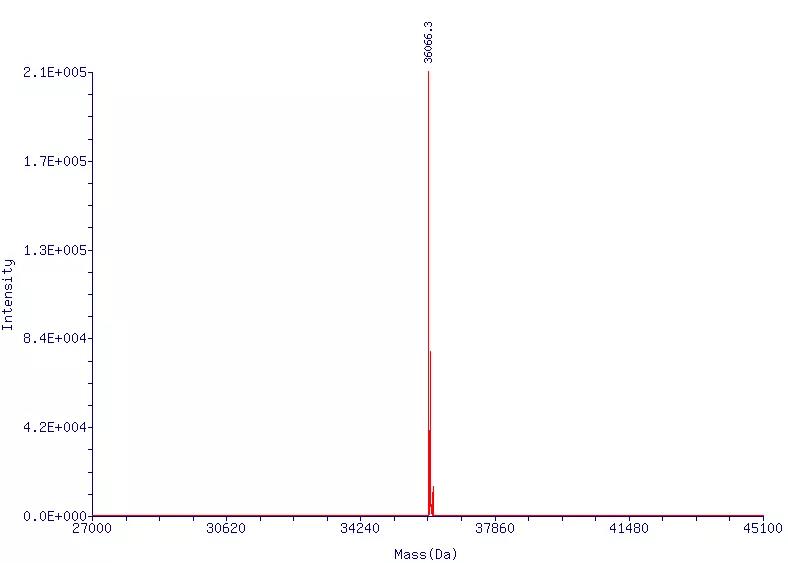
图6.110nt的RNA采用ESI-MS进行QC结果图110nt的RNA的ESI检测图。目标分子量为36060.0,实测分子量为36066.3
参考文献:
[1] Jinek, M.;Chylinski, K.; Fonfara, I.; Hauer, M.; Doudna, J. A.; Charpentier,E. A Programmable Dual-RNA-Guided DNA Endonuclease in AdaptiveBacterial Immunity. Science. 2012. 337(6096),816–821. doi:10.1126/science.1225829[2] Jinek, M.; East,A.; Cheng, A.; Lin, S.; Ma, E.; Doudna, J. RNA-programmed genomeediting in human cells. eLife. 2013. 2,e00471. doi:10.7554/elife.00471[3] Hendel, A.; Bak,R. O.; Clark, J. T.; Kennedy, A. B.; Ryan, D. E.; Roy, S.; Steinfeld,I.; Lunstad, B.D.; Kaiser, R.J.; Wilkens, A. B.; Bacchetta, R.;Tsalenko, A.; Dellinger, D.; Bruhn, L.; Porteus, M. H. Chemicallymodified guide RNAs enhance CRISPR-Cas genome editing in humanprimary cells. Nature Biotechnology. 2015. 33(9),985–989. doi:10.1038/nbt.3290
