围观思路,精读NC文献|揭示天然抗病毒免疫调控新机制
文献精读
中文题目:下调的NDR1通过miR146a-STAT1反馈环路抑制抗病毒天然免疫应答
英文题目:Downregulated NDR1 protein kinase inhibits innate immune response by initiating an miR146a-STAT1 feedback loop
关键词:NDR1、抗病毒免疫反应、ChIP-seq、miR146a-STAT1反馈环路
发表杂志:Nature Communications
阅读时间:20min

研究背景
固有免疫系统是宿主抵抗病原体入侵的第一道防线,固有免疫细胞能够通过模式识别受体(PRRs)识别病原体相关的分子模式(PAMPs),PRRs识别并结合PAMPs后,激活下游信号,经过信号转导诱导I 型干扰素等免疫介质大量产生。I 型干扰素(type I IFN)与细胞膜上的I 型干扰素受体结合,活化与之偶联的激酶,通过JAK-STAT信号转导途径激活下游干扰素诱导基因(ISGs)转录,而ISGs在抗病毒反应中发挥着重要作用。

http://www.ibp.cas.cn/denghylab/denghylabyjfx/201404/t20140428_4101934.html(图片来源)
Toll样受体是一种重要的PRR,表达于固有免疫细胞,如巨噬细胞、树突细胞表面,识别并结合PAMP后启动细胞内信号转导,激活下游免疫反应。miR146a是Toll样受体信号的负反馈调节子,进一步研究表明miR146a靶向影响STAT1和IRAK2等涉及到固有免疫抗病毒反应的蛋白分子的转录。NDR1是一种高度保守的丝氨酸/苏氨酸激酶,是各种细胞生命活动中重要的转录调节子,包括中心体复制、细胞凋亡和肿瘤发生,最近有研究报道巨噬细胞中NDR1可以抑制TLR9介导的炎症反应,而NDR1在抗病毒免疫应答调控研究报道非常少。
病毒的高基因突变特性不断产生逃避机体免疫系统监控的机制,从而周期性地引起全球性恐慌和威胁人类生存,研究并深入理解宿主抗病毒免疫应答调控及病毒逃逸机制对于新型、高效抗病毒药物的开发具有重要意义。
文章亮点
NDR1作为转录调控因子结合于miR146a的intergenic区,使STAT1从miR146a介导的翻译抑制中释放出来,上调STAT1的表达,促进IFN途径激活,有益ISG表达,正向调控天然抗病毒免疫。
该研究不仅丰富了NDR1的生物学功能,并揭示机体抗病毒天然免疫应答及病毒免疫逃逸新机制,将为抗病毒药物的研发提供新思路及新靶点。
研究结果(部分)
1. 病毒感染抑制NDR1表达
研究者对比感染了RSV病人和健康人的外周血样本,感染RSV病人的NDR1 mRNA水平显著降低(如图1)。感染RNA和DNA病毒的小鼠腹腔巨噬细胞(PMs)中NDR1的mRNA(如图2)和蛋白量皆下调。用重组小鼠干扰素β和重组人干扰素α分别处理PMs和细胞株Thp1,结果显示IFNα/IFNβ显著降低了NDR1的mRNA和蛋白的表达量,而在IFNαR或者STAT1缺失的巨噬细胞中NDR1表达量在VSV病毒感染前后表达无明显差异(见图3),显示病毒感染抑制NDR1表达依赖STAT1途径。
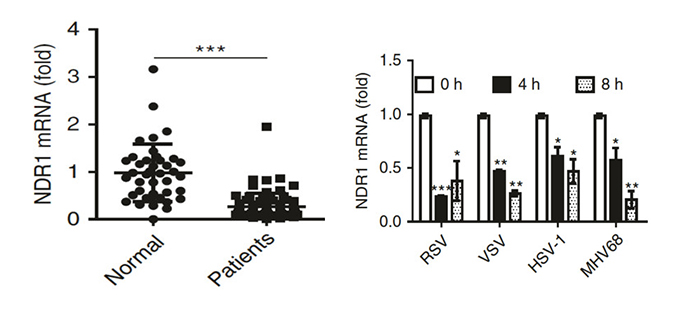
图 1(左) 感染RSV的病人NDR1mRNA量降低 ;图2(右) 感染病毒的小鼠PMs中NDR1mRNA量较对照组降低
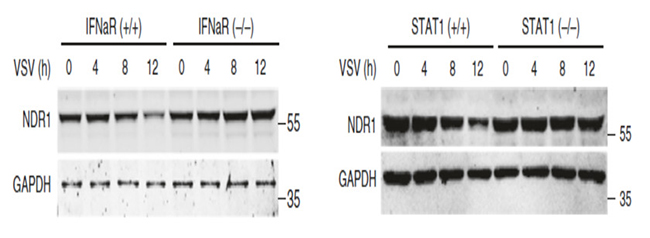
图3 免疫印迹分析NDR1的表达量
2. NDR1促进抗病毒免疫反应
病毒感染后,从NDR1-/-小鼠模型中采集PMs检测抗病毒相关的IFNβ、IL6、TNFα等蛋白的表达量和对照组比较明显减少(如图4);相对的,在RAW264.7细胞株中过表达NDR1或其激酶活性失活突变体, 病毒感染后,细胞均上调I型IFN和ISGs的表达。用VSV-eGFP感染过表达NDR1或其激酶活性失活突变体的RAW264.7细胞株,FACS分析和TCID50评估结果显示过表达NDR1或其激酶活性失活突变体均显著抑制VSV病毒复制(如图5)。
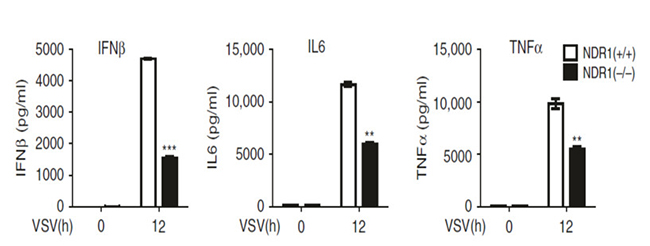
图4 病毒感染后NDR1-/-PMs和WT中抗病毒相关蛋白的ELISA分析
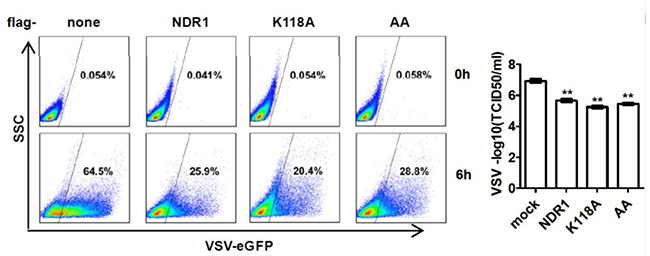
图5 FACS分析和TCID50评估图
模式小鼠活体实验评估NDR1在机体抵抗病毒感染中的重要性,相较于野生型对照组,NDR1-/-小鼠在VSV病毒感染后,肺部组织病理分析发现更严重的水肿、肺泡大出血和中性粒细胞沁润等(如图6 图左);对肝实质分析显示,NDR1-/-模式小鼠门静脉炎性沁润较WT小鼠更丰富(如图6 图右)。感染致死剂量的VSV后NDR1-/-小鼠两天内全部死亡,WT小鼠仅有30%因感染死亡(如图7 图左),静脉注射HSV得到同样的实验结论:NDR1-/-小鼠死亡率高于对照组(如图7 图右)。综上所述,NDR1以激酶活性非依赖的形式促进宿主抗病毒免疫反应。
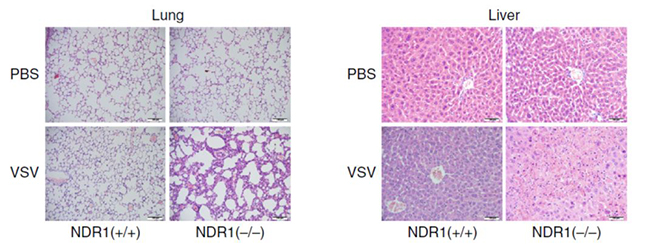
图6 小鼠肝、肺切片染色
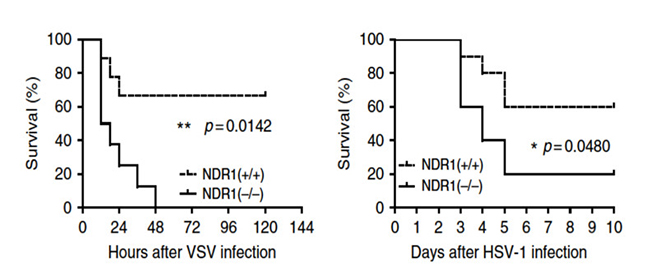
图7 NDR1+/+和 NDR1-/-的8周小鼠感染(图左)/注射(图右)的生存率
3. NDR1促进固有免疫反应的机制研究
首先,本文实验证明NDR1通过靶向STAT1提高抗免疫反应,促进IFN途径激活增加ISGs产物,下面来探索NDR1促进抗病毒免疫反应机制。
a.细胞核内NDR1才能增强STAT1表达
普遍认为NDR1是包含核定位序列(NLS)的细胞核内蛋白,最近的研究发现NDR1也是细胞质激酶,这正与本文章实验结果一致:通过免疫印迹分析和共聚焦实验发现,病毒感染前后巨噬细胞的细胞核和细胞质中均发现NDR1蛋白(如图8)。
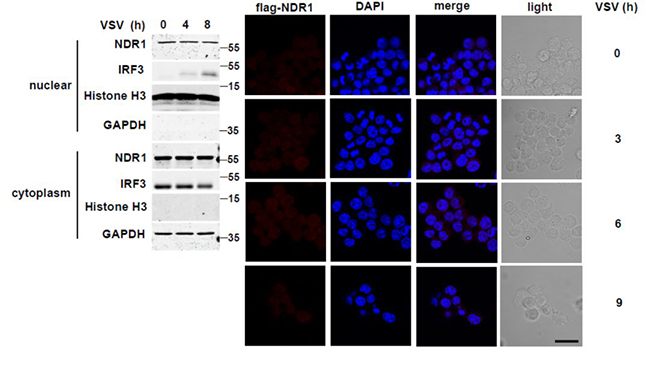
图8 NDR1细胞定位实验图
删除NDR1的NLS序列,抑制其定位到细胞核中,NDR1对STAT1表达的影响会减弱,(如图9 图左)。补充实验结果显示NDR1-/-的巨噬细胞中STAT1的表达水平显著降低,过表达NDR1恢复其表达量,但是过表达NDR1 ⊿NLS突变体不能恢复NDR1-/-巨噬细胞中STAT1的表达量(如图9图右)。本文的实验结果表明核内的NDR1作为抗病毒蛋白分子促进STAT1表达。
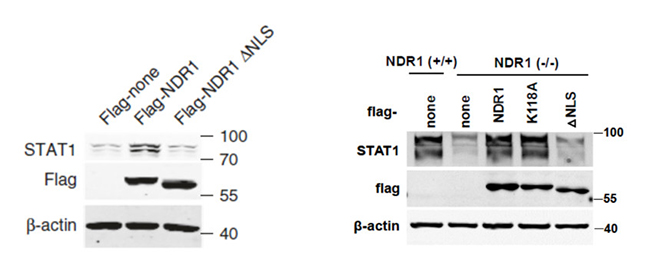
图9 STAT1表达的免疫印迹分析
b.NDR1结合到miR146a的基因间区抑制其转录
本文研究人员假设NDR1为转录调控因子,为了验证这个假设在RAW264.7细胞系中进行ChIP-seq实验:过表达flag-NDR1,使用抗flag抗体免疫沉淀flag-NDR1,分析得到477个NDR1蛋白结合富集峰,其中41.09, 11.32, 42.98和2.10%分别定位在内含子区、外显子区、基因间区和启动子区(如图10 )。根据Motif分析结果,鉴定出NDR1热点结合模式序列:5′-WCHTBRMAATCG-3′ (W =A or T; H= A, T, or C; B = G, T, or C; R = A or G; and M= A or C)。进而鉴定出两个潜在的位于miR146a基因间区的NDR1结合位点,通过生物素-亲和素介导的DNA-pull down实验证明NDR1以激酶活性非依赖的方式直接结合在mi146a基因间区(chr11: 43303808-43303818)
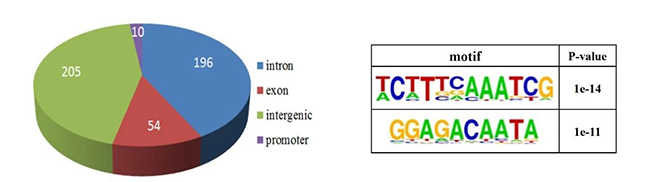
图10 (左)NDR1 ChIP-seq的peaks分布;图11(右) motif分析
已知人的造血细胞中miR146a的转录受NF-κB正向调控,本文进一步研究NDR1减少NF-κB调节的miR146a的表达量是否依赖于NDR1结合到miR146a基因间区序列。在L929细胞中,利用CRISPR-Cas9系统删除miR146a基因间区中NDR1结合的DNA结合位点(DNS),结果显示NDR1对miR146a、STAT1和病毒诱导的ISGs表达的影响消失(如图12)。一系列的实验结果表明NDR1是通过结合到mi146a的基因间区抑制其转录。
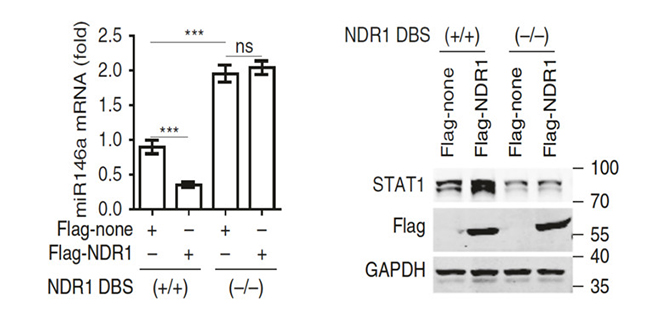
图12 NF-κB富集的qPCR分析和STAT1表达的免疫印迹分析
c. NDR1通过靶向miR146a促进STAT1翻译
正如图13(图左)展示,巨噬细胞中抑制miR146a表达后,NDR1不再影响STAT1的表达量。为了调查研究NDR1对STAT1翻译和促进抗病毒反应的影响是否依赖于miR146a,本文章构建了过表达pre-miR146a的L929细胞系,进一步的实验结果显示:对照组中过表达NDR1能够上调STAT1和VSV诱导的ISGs的表达量, 但是这一影响在过表达pre-miR146a的实验组中消失(如图13 图右)。一系列实验结果表明NDR1上调STAT1表达量、刺激免疫反应需要依赖miR146a。
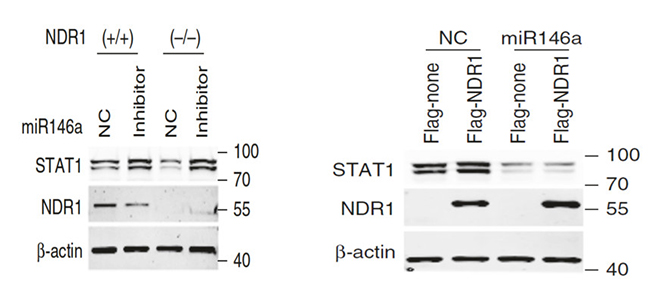
图13不同条件下STAT1表达的免疫印迹分析
4. miR146a-STAT1反馈环路
细胞中miRNA和转录因子间的协同调控广泛存在,已有报道STAT1和miR-155-5p之间的反馈环路参与肿瘤发生。实验显示敲低和敲除STAT1能够显著提高miR146的表达量(如图14 图左)。研究人员在小鼠的mi146a的启动子区域找到了STAT1潜在的结合序列,ChIP-qPCR结果显示STAT1结合区域和NF-κB的相重叠,猜测两者竞争性结合miR146a的调控序列。在STAT1-/-和WT巨噬细胞中用抗NF-κB抗体做ChIP实验,前者结合miR146a调控序列的NF-κB量显著增加(如图14 图中)证实了这一假设。miR146a和STAT1相互抑制:miR146a通过靶向STAT1mRNA的3′-UTR下调其翻译,而STAT1结合到miR146a启动子区域抑制其转录组,形成反馈环路(如图14 图右)。
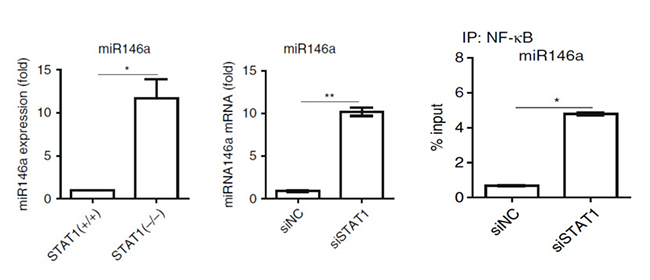
图14 miR146a的qPCR分析(图左和图中)、NF-κB富集的ChIP-qPCR分析(图右)
文章结论
该研究发现Dbf 2相关激酶1(NDR1)以激酶活性非依赖形式促进体内外抗病毒天然免疫应答。NDR1基因敲除小鼠对病毒及李斯特杆菌的感染表现出更高的易感性。通过ChIP-seq研究发现,NDR1作为转录调控因子结合于miR146a的intergenic区。而结合于miR146a的intergenic区的NDR1抑制了miR146a转录,使STAT1从miR146a介导的翻译抑制中释放出来,上调STAT1的表达,正向调控天然抗病毒免疫反应。
同时该研究还发现,STAT1 作为负向转录调控因子结合到miR146a的启动子区抑制miR146a的表达,揭示miR146a-STAT1相互抑制环路。更为重要的是,病毒和细菌入侵通过I型IFN信号通路下调 NDR1 的表达,导致miR146a表达上升,STAT1 表达下降,抑制机体抗病毒免疫应答。
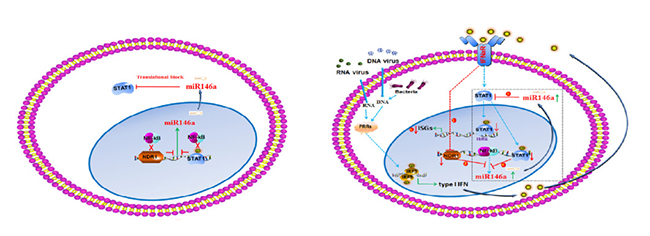
Downregulation of NDR1 due to viral infection inhibits the innate immune response by initiating an miR146a-STAT1 feedback loop.
致谢:
非常感谢文章作者(共一)刘志勇博士对本篇解读提出的宝贵意见!
